
Las imágenes de microscopía electrónica revelan la presencia de muchas vesículas interconectadas, que parecen comportarse como portadores de colágeno (indicados por flechas). Crédito: Comunicaciones de investigación bioquímica y biofísica
Investigadores del Instituto de Tecnología de Tokio (Tokyo Tech) han identificado una enzima que controla la cantidad de colágeno que secretan las células. Dado que el desequilibrio del colágeno está relacionado con una variedad de enfermedades humanas, el estudio proporciona pistas sobre nuevas estrategias terapéuticas. Es más, los hallazgos podrían facilitar la producción eficiente de colágeno para los alimentos, industrias cosmética y farmacéutica.
Todas las células producen y liberan proteínas. Las proteínas se empaquetan como "carga" en pequeños, vesículas similares a burbujas antes de ser transportadas fuera de la célula. Este proceso, conocido como secreción, es vital para un crecimiento y desarrollo saludables.
Aunque muchos estudios han demostrado cómo estas vesículas, llamados portadores COPII, manejar carga de tamaño relativamente pequeño, pocos se han centrado en el funcionamiento de portadores inusualmente grandes conocidos por empaquetar proteínas muy grandes, como el colágeno.
Ahora, un estudio de investigadores como Masayuki Komada, Toshiaki Fukushima y el estudiante de posgrado Kohei Kawaguchi del Instituto de Tecnología de Tokio han identificado a la USP8 como una enzima clave involucrada en el control de la formación de grandes portadores de colágeno. Han informado sus hallazgos en la revista. Comunicaciones de investigación bioquímica y biofísica .
El equipo demostró que "encender" la USP8 inhibía la formación de grandes portadores, y por lo tanto reduce la secreción de colágeno. En cambio, apagar USP8 promovió el transporte de colágeno, lo que condujo a una mayor secreción de colágeno. (Vea las Figuras 1-3.)
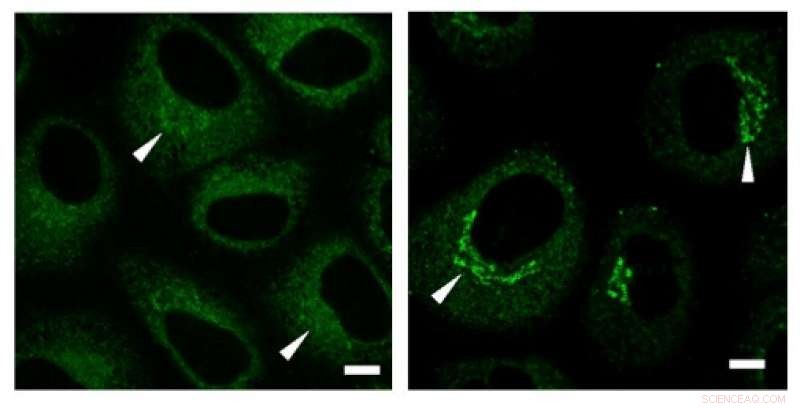
Los experimentos de inmunotinción revelaron una alta concentración de colágeno (señales verdes) en la región de Golgi antes de la secreción. Crédito: Comunicaciones de investigación bioquímica y biofísica
Los hallazgos tienen grandes implicaciones para la medicina y la biotecnología. Se sabe que la secreción excesiva de colágeno en el cuerpo humano causa fibrosis de órganos, mientras que muy poca secreción de colágeno se asocia con enfermedades óseas, incluida la displasia craneo-lentículo-sutural (CLSD) y el síndrome de Cole-Carpenter. Se podrían desarrollar nuevos tratamientos para estas enfermedades mediante una mayor comprensión del modo de acción exacto de la USP8. Este conocimiento también podría proporcionar nuevas formas de aumentar la producción comercial de colágeno.
Los investigadores han demostrado que la enzima funciona desubiquitinando una proteína llamada Sec31A, un componente de la cubierta de la vesícula COPII necesaria para la exportación de proteínas.
Un grupo particular de proteínas llamado complejo USP8-STAM1 parece ser responsable de la desubiquitinación de Sec31A, como se ilustra en la Figura 3.
El estudio se basa en muchos años de investigación que han iluminado la versatilidad de USP8.
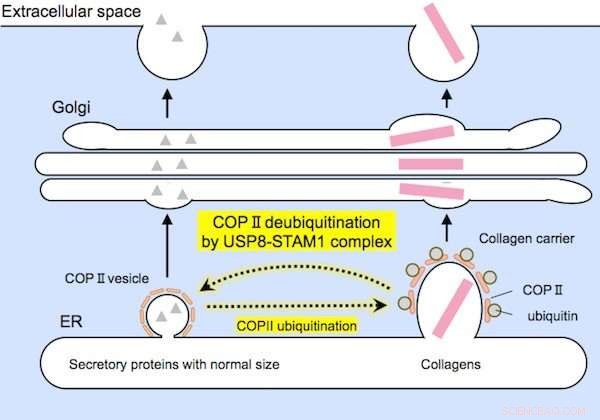
Las proteínas de tamaño relativamente pequeño (a la izquierda) y los colágenos grandes (a la derecha) son encapsuladas por portadores de COPII de tamaños adecuados antes de la secreción. El complejo USP8-STAM1 inhibe la formación de grandes portadores de colágeno. Crédito: Comunicaciones de investigación bioquímica y biofísica
"Anteriormente habíamos informado que la USP8 regula la secreción de hormonas pituitarias, "dice Fukushima, refiriéndose a un artículo publicado en Genética de la naturaleza en 2015. "En el proceso de ese estudio, descubrimos accidentalmente que el complejo USP8-STAM1 se une a Sec31 ".
Fue este hallazgo "accidental", combinado con resultados prometedores de otros grupos en los EE. UU., que llevó al equipo a examinar el papel de USP8 en la formación de portadores COPII.
En investigaciones que se remontan a más de una década, Komada y otros han aclarado el papel convencional de la USP8 en la regulación de la endocitosis5. "Es muy interesante que ahora se haya demostrado que el mismo complejo USP8-STAM1 juega un papel importante tanto en la regulación de la endocitosis como en la secreción, "Dice Fukushima.
Por tanto, el presente estudio revela una "nueva cara" de la enzima USP8, y Fukushima insinúa que puede haber más sorpresas por venir. USP8 pertenece a una familia de alrededor de 90 enzimas desubiquitinantes conocidas, que siguen siendo un tema candente en biología celular.