
Los científicos de la Universidad de Groningen, el Dr. Hein Wijma (izquierda) y el Prof.Dr. Dick B. Janssen, que utilizó un nuevo enfoque computacional para rediseñar la enzima aspartasa y convertirla en un catalizador para reacciones asimétricas de hidroaminación. Crédito:Universidad de Groningen
Los biotecnólogos de la Universidad de Groningen utilizaron un método computacional para rediseñar la aspartasa y convertirla en un catalizador para reacciones asimétricas de hidroaminación. Sus colegas en China aumentaron la producción de esta enzima y lograron producir kilogramos de componentes básicos muy puros para productos farmacéuticos y otros compuestos bioactivos. Este exitoso estudio de prueba de principio fue publicado en Biología química de la naturaleza el 21 de mayo.
Las enzimas son catalizadores naturales que funcionan en condiciones suaves. Son una alternativa atractiva a las reacciones químicas no catalizadas que a menudo requieren altas temperaturas o presiones que consumen energía y pueden generar productos secundarios tóxicos o utilizar disolventes. Pero hay un problema:la gama de reacciones catalizadas por enzimas es limitada. "Es por eso que se está haciendo un gran esfuerzo para modificar las enzimas naturales, "explica Dick Janssen, Catedrático de Biotecnología Química en el Instituto Biomolecular y Biotecnológico de Groningen.
El método clásico para modificar enzimas es la evolución dirigida, una secuencia de selección de mutaciones en el laboratorio que tiene como objetivo crear enzimas con capacidades catalíticas modificadas. Pero se necesita mucho trabajo para hacer y probar cientos o miles de variantes de enzimas en múltiples rondas. Sería mucho más eficiente hacer un diseño racional de los cambios requeridos basándose en información sobre la estructura y propiedades de la enzima.
Pero incluso esto es complicado explica Hein Wijma. Es un experto en software de diseño molecular y realizó la mayor parte del trabajo computacional del estudio. "Las proteínas están compuestas de 20 aminoácidos diferentes. Por lo tanto, si desea cambiar una enzima en cuatro posiciones, hay 20 opciones para cada uno de ellos. Eso da como resultado una enorme matriz de estructuras de proteínas ". Probándolas una por una, incluso en la computadora, toma mucho tiempo. Sin embargo, un algoritmo de búsqueda de Monte Carlo muy rápido acelera el descubrimiento del resultado correcto al buscar tendencias en la reactividad de la enzima.
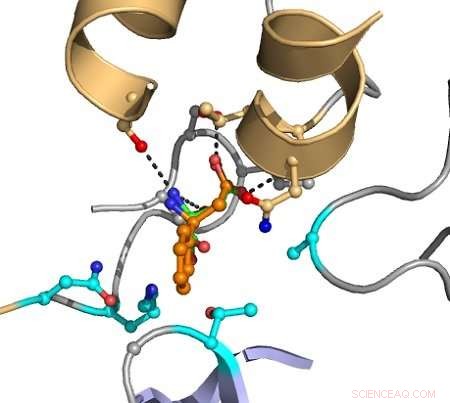
Las líneas discontinuas indican interacciones entre átomos que provocan catálisis. El sustrato objetivo se muestra en naranja, y los grupos indicados en magenta se van variando en la computadora para descubrir mutantes que mejoren la conversión. Crédito:Hein Wijma / Universidad de Groningen
"En el final, llevó un par de días realizar esta búsqueda en un clúster informático dedicado en la Universidad de Groningen, "dice Wijma. Pero se necesitaba mucho modelado de antemano." Tienes que modelar el centro reactivo, los bolsillos donde se une el sustrato, y determinar la distancia entre los aminoácidos y sus posiciones relativas y ángulos ". Como el grupo usó una enzima (aspartasa) como punto de partida para varias reacciones diferentes, el punto de partida siempre fue el mismo. Esto significaba que solo tenían que cambiar la reacción del objetivo. Wijma:"Si quisiéramos hacer una nueva modificación de aspartase, eso probablemente solo tomaría tres meses ahora ".
El artículo de investigación describe cuatro conversiones, todas las adiciones de amonio. La aspartasa es una desaminasa, por lo que la reacción se invirtió. "La catálisis va en ambos sentidos, así que eso no es un problema mayor, "dice Janssen. Para cada conversión, la selección inicial por el algoritmo produjo unos 100 mutantes prometedores. Luego, se verificaron errores obvios. Janssen:"Al final, entre cinco y veinte mutantes se fabricaron en el laboratorio y se probaron para ver si funcionaban como se esperaba ".
El siguiente paso fue probar enzimas mutantes exitosas en un entorno ampliado. "Este trabajo fue realizado por un ex estudiante de doctorado y postdoctorado de nuestro laboratorio, Bian Wu, que ahora es profesor asistente en China, "dice Janssen." Mostró qué candidatos podían producir grandes cantidades del producto requerido. "Se lograron conversiones de sustrato del 99 por ciento con una enantioselectividad del 99 por ciento en cantidades de hasta un kilogramo, lo que significa que las enzimas predichas por los métodos de cálculo parecen adecuadas para su uso en un entorno industrial. "Esta es una prueba real del principio de que nuestro método de selección in-silico de mutantes funciona para producir enzimas útiles, "concluye Janssen.