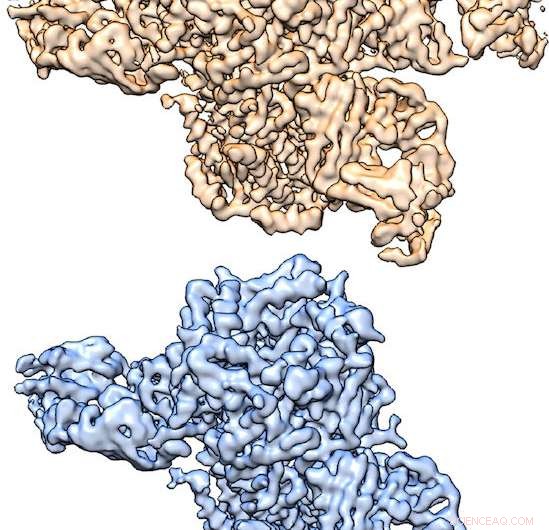
Estructuras tridimensionales del receptor nicotínico de acetilcolina determinadas por crio-EM, cortesía de Hibbs Lab. Crédito:Laboratorio Hibbs, UT Southwestern Medical Center
Investigadores de UT Southwestern publicaron hoy en Naturaleza planos a escala atómica de la clase más abundante de receptores cerebrales nicotínicos de acetilcolina. Una comprensión estructural de la proteína, encontrado en neuronas, podría conducir a nuevas formas de tratar la adicción a la nicotina por fumar y vapear.
Estructuras tridimensionales del receptor nicotínico de acetilcolina determinadas por crio-EM, cortesía de Hibbs Lab. "Cuando este receptor se une al neurotransmisor acetilcolina o a la nicotina, conduce a la activación de la neurona, que luego envía señales a otras neuronas, "dijo el Dr. Ryan Hibbs, autor correspondiente del estudio y profesor asistente de neurociencia y biofísica del Instituto del Cerebro Peter O'Donnell Jr. en UT Southwestern. "Este proceso de 'neurotransmisión química' es la base de toda comunicación rápida entre neuronas. Este receptor específico está estrechamente relacionado con la adicción a la nicotina".
Los investigadores obtuvieron las estructuras de alta resolución utilizando la instalación de microscopía crioelectrónica (cryo-EM) de $ 22.5 millones de la Universidad, donde las muestras se congelan rápidamente para evitar la formación de cristales de hielo dañinos y luego se ven a menos 321 grados Fahrenheit (temperaturas criogénicas). La instalación de UT Southwestern, que funciona las 24 horas, es una de las instalaciones más importantes del mundo para la biología estructural crio-EM.
Dos aspectos novedosos del estudio lo distinguen en los campos de la biología estructural y la neurociencia. Primero, los investigadores descubrieron una nueva biología sobre cómo el receptor se une a la nicotina en el cerebro, Dijo el Dr. Hibbs. En segundo lugar, están los hallazgos relacionados con los aspectos técnicos de cómo se ensambla la proteína.
"El descubrimiento que hicimos sobre las diferentes formas en que la nicotina interactúa con este receptor puede ayudar a diseñar medicamentos para tratar la adicción a la nicotina y la neurodegeneración, ", agregó." Con respecto al montaje del receptor, Las técnicas clásicas de determinación de estructuras generalmente requieren una muestra homogénea. Sin embargo, para esta proteína, el receptor se ensambla de múltiples formas que tienen importantes consecuencias biológicas. Por ejemplo, un desequilibrio en la proporción de los dos arreglos de subunidades está relacionado tanto con la adicción a la nicotina como con la epilepsia congénita ".
La proteína que estudiaron se compone de cinco subunidades, de dos tipos:α y β. Estas subunidades α y β se ensamblan en dos proporciones diferentes en dos complejos distintos de cinco subunidades, una forma 3α:2β y una forma 2α:3β. Los complejos de ambas proporciones se encuentran en el cerebro.
"Utilizamos un enfoque de etiquetado de anticuerpos para identificar subunidades y superar los desafíos en el cómputo crio-EM para obtener estructuras de ambos complejos de cinco subunidades a partir de una sola muestra. Esto no se había hecho antes y proporciona un enfoque general para determinar las estructuras de muchos otros tipos de canales y receptores de múltiples subunidades que tienen múltiples formas de ensamblarse, "explicó el Dr. Hibbs, una becaria Effie Marie Cain en investigación médica.
"Las dos estructuras están compuestas por diferentes proporciones de subunidades α y β. Al usar un anticuerpo que se une solo a las subunidades β, pudimos extraer las dos estructuras de una muestra:un receptor tiene dos anticuerpos unidos, mientras que el otro tiene tres atados, "explicó el autor principal Richard Walsh Jr., estudiante de posgrado en el programa de Biofísica Molecular.
"Ser el autor principal de un manuscrito aceptado es en sí mismo una experiencia extremadamente gratificante; ser el autor principal de un estudio aceptado por Naturaleza todavía se siente surrealista, "añadió.
El laboratorio de Hibbs pudo obtener previamente una estructura de uno de los dos complejos mediante cristalografía de rayos X, una primera vez en ese momento debido a la dificultad de cristalizar las proteínas de membrana.
"Para las proteínas de membrana en particular, obtener cristales que se difractarán a alta resolución es un desafío, lo que hace que cryo-EM sea particularmente poderoso. Previamente pudimos obtener uno de estos arreglos de subunidades del receptor nicotínico mediante cristalografía de rayos X. Cryo-EM nos dio ambos arreglos, de una sola muestra, a mayor resolución, "Dijo el Dr. Hibbs.