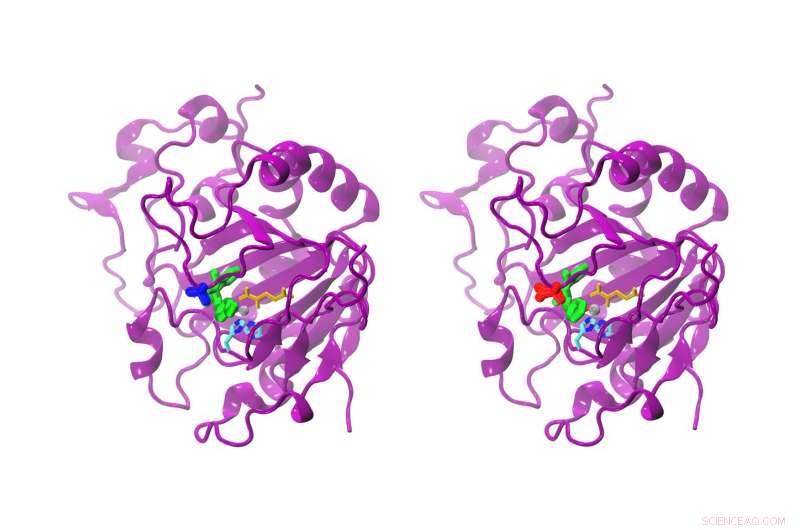
Si bien la diferencia entre el AsqJ natural y el modificado es solo un aminoácido, la reactividad es claramente diferente. El AsqJ natural (izquierda) posee una valina en la posición 72 (azul). La forma modificada posee una isoleucina (roja) en la posición 72. El sustrato en el sitio activo es de color verde, alfa-cetoglutarato amarillo, el átomo de hierro gris, y dos cadenas de histidina cian y azul. Crédito:Sophie Mader / TUM
Prácticamente todos los procesos bioquímicos involucran enzimas que aceleran las reacciones químicas. Un equipo de investigación de la Universidad Técnica de Munich (TUM) ha descifrado por primera vez el mecanismo molecular de la enzima AsqJ. Sus hallazgos podrían abrir nuevas opciones en la producción de moléculas farmacéuticamente activas.
Sin enzimas, la naturaleza se paralizaría. Estas pequeñas moléculas aceleran las reacciones bioquímicas o las hacen posibles en primer lugar. Pero, ¿cómo sucede esto a nivel molecular? "Comprender la función exacta de las enzimas es uno de los mayores desafíos de la bioquímica moderna, "dice Ville Kaila, Catedrático de Biocatálisis Computacional en la Universidad Técnica de Munich.
El equipo de investigación dirigido por Ville Kaila y Michael Groll, Catedrático de Bioquímica en la Universidad Técnica de Munich, tengo, por primera vez, descifrado el mecanismo de la enzima aspoquinolona J (AsqJ), una dioxigenasa que activa los enlaces de carbono con el oxígeno.
La enzima AsqJ es particularmente interesante ya que cataliza una cascada de reacciones químicas que finalmente conducen a la formación de compuestos antibacterianos. Fue descubierto hace solo unos años en el Aspergillus nidulans hongo. Los investigadores combinaron diferentes métodos para descubrir los secretos que contiene la enzima:Primero, Alois Bräuer y el profesor Michael Groll utilizaron cristalografía de rayos X para determinar la estructura atómica tridimensional de la molécula. Sophie Mader y Ville Kaila luego utilizaron esta información para realizar simulaciones de mecánica cuántica en sus procesos bioquímicos.
"Nuestros cálculos ilustran cómo la enzima cataliza la formación del alcaloide quinolónico, "informa Kaila." Los pequeños detalles tienen efectos asombrosos:un ligero cambio en el sustrato, como la eliminación de un pequeño grupo químico, es suficiente para detener prácticamente la reacción ".
Próximo, el equipo diseñó computacionalmente una nueva variante de la enzima que cataliza la formación de alcaloides quinolónicos con el sustrato modificado. Esta nueva enzima se produjo experimentalmente en bacterias y se probó su funcionalidad. "Los resultados fueron impresionantes:la reacción esperada tuvo lugar después de solo unos segundos, "recuerda Bräuer.
"Este experimento demuestra que nuestra metodología funciona y también es adecuada para representar la funcionalidad de otras enzimas a nivel molecular, "dice Ville Kaila. El diseño de enzimas todavía se encuentra en un nivel básico, pero tiene un potencial enorme. En el futuro, podríamos apuntar a diseñar medicamentos médicos computacionalmente, por ejemplo.
“El trabajo demuestra que nuestra metodología es precisa y también muy adecuada para estudiar la funcionalidad de otras enzimas a nivel molecular, ", dice Ville Kaila. El diseño de enzimas es todavía una investigación básica, pero tiene un potencial enorme. Un objetivo de la investigación futura será diseñar enzimas en una computadora para, por ejemplo, producir nuevos fármacos.