Crédito:Universidad Estatal de Carolina del Norte
Investigadores de la Universidad Estatal de Carolina del Norte han modelado y analizado los modos de unión de 210 moléculas que previamente se informó que inhiben la función de una familia de enzimas involucradas en la regulación de la sal y la presión arterial en el cuerpo humano. Sus hallazgos podrían ayudar a los investigadores a comprender mejor las complejas relaciones entre la regulación de la sal, hipertensión y presión arterial alta.
La familia de enzimas With-No-Lysine (WNK) es un grupo de cuatro proteínas que participan en la regulación de la presión arterial y los fluidos corporales. Estas enzimas están relacionadas con una forma rara y grave de hipertensión; sin embargo, sus funciones individuales no se comprenden bien. Para comprender mejor el papel de cada enzima, los investigadores necesitan desarrollar moléculas específicas que puedan apagar selectivamente su función. Las moléculas actualmente en uso se unen con las cuatro proteínas WNK, impidiendo que los investigadores descubran diferencias funcionales entre cada uno.
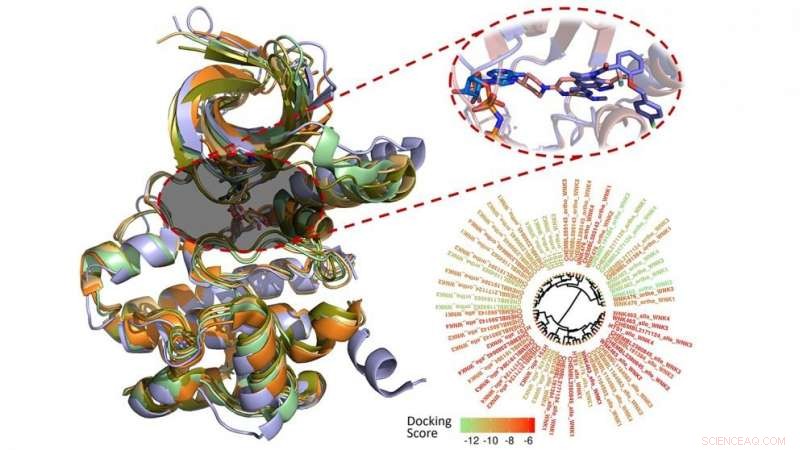
Denis Fourches, profesor asistente de química computacional, y la investigadora postdoctoral Melaine Kuenemann utilizó modelos informáticos para caracterizar, analizar y visualizar cada una de las 210 moléculas que se sabe que se unen a la familia WNK.
Fourches y Kuenemann crearon modelos 3D de los 210 compuestos y los acoplaron en el bolsillo de unión de cada enzima WNK. Luego, midieron qué tan bien se unían realmente los compuestos y analizaron sus interacciones específicas dentro de los cuatro bolsillos de unión diferentes. Incluso realizaron simulaciones de dinámica molecular en tiempo real para estudiar cómo variaban estas interacciones a lo largo del tiempo. revelando nuevas formas de hacer moléculas más selectivas hacia una enzima WNK específica.
"No se sabe que muchos compuestos inhiban la familia de quinasas WNK, y las que tenemos se unen a las cuatro enzimas, "Dice Fourches." Si queremos comprender mejor las conexiones entre estas proteínas y la hipertensión, necesitamos identificar los productos químicos que pueden apagar una cinasa WNK a la vez y, por lo tanto, interrogar mejor su función individual.
"Este es el primer estudio que intenta analizar el 'panorama general' de estos inhibidores de WNK utilizando simulaciones informáticas de última generación. Esperamos que nuestros hallazgos ayuden a los químicos médicos y otros investigadores a diseñar nuevas moléculas con mayor unión potencia y selectividad hacia cada quinasa WNK individual ".
La obra aparece en Informática molecular .