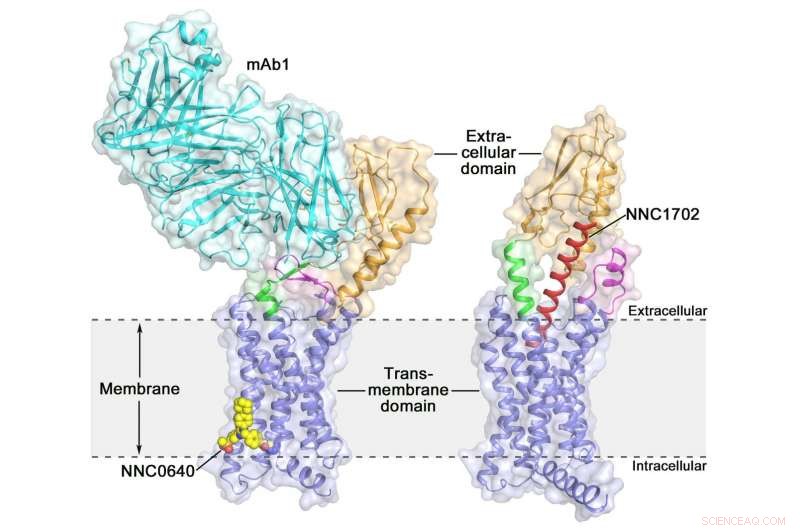
La estructura cristalina del receptor de glucagón humano de longitud completa (GCGR) estructura cristalina del receptor de glucagón humano de longitud completa (GCGR):naranja (dominio extracelular), azul (dominio transmembrana), verde (tallo), magenta (el primer bucle extracelular), rojo (NNC1702), amarillo (NNC0640) y cian (mAb1) Crédito:Dr. WU Beili
Los receptores acoplados a proteínas G (GPCR) de clase B ejercen una acción esencial en la homeostasis hormonal y son importantes dianas terapéuticas para una variedad de enfermedades que incluyen trastornos metabólicos como la diabetes tipo 2. Estos receptores consisten en un dominio extracelular (ECD) y un dominio transmembrana (TMD), ambos deben interactuar con sus ligandos peptídicos afines y regular la transducción de señales aguas abajo. Debido a las dificultades en la preparación de proteínas de alta calidad, La determinación de la estructura de los GPCR de clase B de longitud completa sigue siendo un desafío, limitando así la comprensión de los mecanismos moleculares de acción del receptor.
La activación del receptor de glucagón humano (GCGR) por su ligando endógeno glucagón desencadena la liberación de glucosa del hígado durante el ayuno. convirtiéndolo en un posible objetivo farmacológico para la diabetes tipo 2. El año pasado, un grupo de científicos del Instituto de Materia Médica de Shanghai (SIMM) de la Academia de Ciencias de China determinó la estructura cristalina del GCGR de longitud completa unido a un modulador alostérico negativo NNC0640 y un anticuerpo inhibidor mAb1, proporcionando así por primera vez una imagen clara de un GPCR clase B de longitud completa a alta resolución.
Recientemente, Los científicos de SIMM determinaron la estructura cristalina de GCGR en complejo con un análogo de glucagón y un agonista parcial NNC1702. Esta estructura revela, por primera vez, los detalles moleculares de un GPCR de clase B que se une a su ligando peptídico en alta resolución y revela inesperadamente la complejidad estructural que gobierna la activación del receptor, ampliando así en gran medida la comprensión de la transducción de señales GPCR de clase B. El estudio fue publicado en Naturaleza .
Este estudio ofrece información valiosa sobre el mecanismo de activación de GCGR. El hallazgo más interesante es que la región enlazadora que conecta el ECD y el TMD del receptor, llamado el "tallo, "y el primer bucle extracelular experimenta cambios conformacionales significativos en sus estructuras secundarias en la estructura GCGR unida al péptido en comparación con la estructura no unida al péptido determinada previamente. Esto conduce a un cambio marcado en la orientación relativa entre el ECD y el TMD del receptor para acomodar la unión de péptidos e iniciar la activación del receptor.
Es más, el tallo puede modular la actividad del receptor facilitando los movimientos conformacionales del receptor TMD. "Es sorprendente observar cómo la región del tallo juega un papel tan importante en la regulación de la función del receptor, aunque solo contiene 12 aminoácidos, ", dijo el profesor de SIMM Dr. ZHAO Qiang." Esto nunca se ha observado en estudios estructurales de GPCR previamente resueltos. Profundiza significativamente el conocimiento sobre los mecanismos de señalización GPCR de clase B ".
Basado en la estructura del complejo GCGR-NNC1702, los investigadores realizaron una serie de estudios funcionales utilizando técnicas como la unión competitiva de ligandos, señal telefónica, Simulaciones de dinámica molecular y espectroscopía de resonancia de doble electrón-electrón. Los resultados apoyan la estructura del GCGR y confirman las alteraciones conformacionales del receptor en diferentes estados funcionales.
"La estructura GCGR recientemente resuelta proporciona la plantilla más precisa hasta la fecha para el diseño de fármacos dirigidos a GCGR, que ofrece nuevas oportunidades en el descubrimiento de fármacos para el tratamiento de la diabetes tipo 2, "dijo el líder del equipo y profesor del SIMM, Dr. WU Beili.