Un equipo de investigación de la Universidad de Kyushu realizó la síntesis electroquímica continua de un compuesto alcohólico a partir de un ácido carboxílico utilizando una celda de electrosíntesis de alcohol electrolítico polimérico, que permite la carga de energía directa en el compuesto alcohólico. Crédito:Masaaki Sadakiyo / Instituto Internacional para la Investigación de Energía Neutral en Carbono, Universidad de Kyushu
El interés por las energías renovables sigue creciendo. Muchas energías renovables, aunque, puede ser frustrantemente intermitente. Cuando el sol está oscurecido por las nubes, o el viento deja de soplar, el poder fluctúa. El suministro fluctuante se puede suavizar en parte mediante el almacenamiento de energía durante las horas pico de producción. Sin embargo, almacenar electricidad no está exento de desafíos.
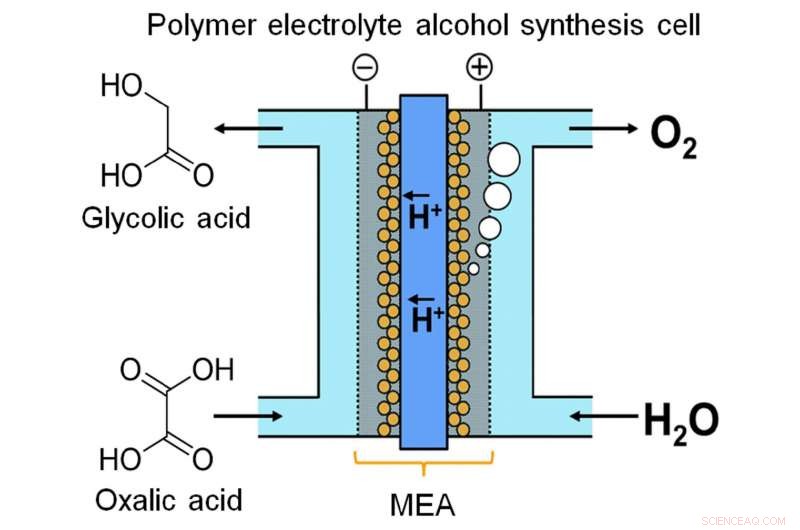
Recientemente, un equipo de la Universidad de Kyushu creó un dispositivo para almacenar energía en forma química mediante electrólisis continua. Los investigadores notaron que el ácido glicólico (GC) tiene una capacidad energética mucho mayor que el hidrógeno, uno de los productos químicos de almacenamiento de energía más populares. La GC se puede producir mediante la reducción de cuatro electrones de ácido oxálico (OX), un ácido carboxílico ampliamente disponible. Como se describe en su publicación en Informes científicos , el equipo diseñó una celda electrolítica basada en un novedoso conjunto membrana-electrodo. Intercalados entre dos electrodos hay un ánodo a base de óxido de iridio y un cátodo de titanio (Ti) recubierto de dióxido de titanio (TiO2), unidos por una membrana de polímero.
"Los sistemas de flujo son muy importantes para el almacenamiento de energía con reacción en fase líquida, "dice el autor principal Masaaki Sadakiyo." La mayoría de los electrolizadores que producen alcoholes operan en un proceso por lotes, que no es adecuado para este propósito. En nuestro dispositivo, mediante el uso de un electrolito de polímero sólido en contacto directo con los electrodos, podemos ejecutar la reacción como un flujo continuo sin adición de impurezas (por ejemplo, electrolitos). La solución OX puede considerarse efectivamente como una reserva de electrones fluida ".
Otra consideración clave es el diseño del cátodo. La reacción catódica es catalizada por anatasa TiO2. Para garantizar una conexión sólida entre el catalizador y el cátodo, el equipo "cultivó" TiO2 directamente sobre Ti en forma de malla o fieltro. Las imágenes de microscopio electrónico muestran el TiO2 como una tenue pelusa, aferrándose al exterior de las varillas de Ti como una capa de nieve fresca. De hecho, su trabajo es catalizar la electro-reducción de OX a GC. Mientras tanto, en el ánodo, el agua se oxida a oxígeno.
El equipo descubrió que la reacción se aceleraba a temperaturas más altas. Sin embargo, subir demasiado la temperatura fomentaba un subproceso no deseado:la conversión de agua en hidrógeno. El equilibrio ideal entre estos dos efectos estaba a 60 ° C. A esta temperatura, el dispositivo podría optimizarse aún más reduciendo el flujo de reactivos, mientras aumenta la cantidad de superficie disponible para la reacción.
Curiosamente, incluso la textura del catalizador de TiO2 difuso marcó una gran diferencia. Cuando se preparó TiO2 como un "fieltro, "al cultivarlo en varillas de Ti más delgadas y densamente empaquetadas, la reacción ocurrió más rápido que en la malla, probablemente debido a la mayor superficie. El fieltro también desalentó la producción de hidrógeno, cubriendo la superficie de Ti más cómodamente que la malla, evitando la exposición del Ti desnudo.
"En las condiciones adecuadas, nuestra celda convierte casi el 100 por ciento de OX, que nos parece muy alentador, ", dice el coautor Miho Yamauchi." Calculamos que la capacidad máxima de energía volumétrica de la solución de GC es alrededor de 50 veces la del gas hidrógeno. Para ser claro, la eficiencia energética, a diferencia de la capacidad, todavía está por detrás de otras tecnologías. Sin embargo, este es un primer paso prometedor hacia un nuevo método para almacenar el exceso de corriente ".