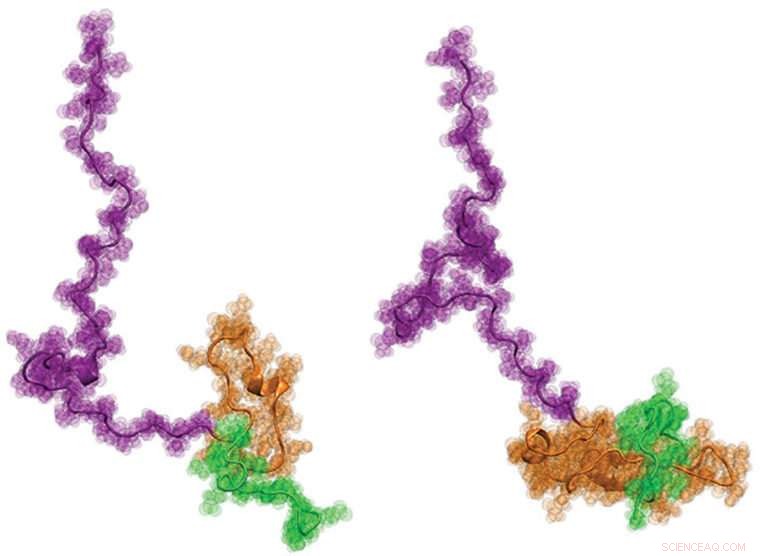
Una cohorte internacional de científicos, incluidos ingenieros de la Universidad de Washington en St. Louis, recientemente visualizó la proteína de Huntington por primera vez. Se espera que saber más sobre la estructura, que tiene forma de renacuajo, pueda ayudar a informar mejor el desarrollo de nuevas terapias para la enfermedad. Crédito:Universidad de Washington en St. Louis
La enfermedad de Huntington es progresiva, trastorno neurodegenerativo mortal causado por mutaciones en un gen específico llamado huntingtina (Htt). En los más de 20 años desde que se identificó el gen Htt, Los investigadores se han centrado en la proteína codificada por el gen Htt, llamado Httex1. Esta proteína se acumula en el cerebro de los pacientes con enfermedad de Huntington, y la hipótesis predominante ha sido que sufre un cambio estructural dramático cuando un tracto repetitivo del aminoácido glutamina muta en una región aberrantemente larga conocida como tracto de poliglutamina expandida mutacionalmente (polyQ).
Ahora, por primera vez, el equipo de Hilal A. Lashuel en la Ècole Polytechnique Fèdèrale de Lausanne (EPFL) en Suiza; Edward A. Lemke en el Laboratorio Europeo de Biología Molecular (EMBL) en Alemania; y Rohit V. Pappu de la Universidad de Washington en St. Louis ha descubierto una descripción estructural detallada de Htt en función de la longitud de polyQ. El trabajo fue publicado recientemente en la Revista de la Sociedad Química Estadounidense .
Un estudio en tres pasos
Asegurar descripciones estructurales a nivel atómico de Htt de longitud completa y fragmentos de proteínas relevantes para la enfermedad denominados Httex1 ha sido un desafío porque estas moléculas se adhieren entre sí e inhiben la generación de muestras de proteínas puras para estudios estructurales. "Es muy difícil obtener la caracterización estructural de las proteínas dentro de una papilla, "dijo Pappu, el Profesor Edwin H. Murty de Ingeniería en la Escuela de Ingeniería y Ciencias Aplicadas.
"Nuestro objetivo era obtener información sobre cómo el aumento de la longitud de la repetición de la cola de polyQ altera la estructura de esta proteína a nivel de monómero y en condiciones en las que podemos desvincular su plegamiento y autoensamblaje, "dijo Lashuel, profesor de ciencias de la vida y director del laboratorio de biología química de la neurodegeneración de la EPFL.
En el primer paso del estudio, Lashuel y el becario postdoctoral John B. Warner IV utilizaron estrategias químicas novedosas en su laboratorio para producir muestras de alta pureza de Htt para espectroscopia molecular. Pero estos solo llegaron en concentraciones ultrabajas y requirieron técnicas que sondean moléculas individuales. Warner y Lashuel permitieron estos experimentos generando muestras con etiquetas fluorescentes específicas del sitio.
Para el segundo paso del proyecto, Warner y Lashuel trabajaron con el laboratorio de Lemke en EMBL para realizar la transferencia de energía de resonancia de Förster (o fluorescencia) de una sola molécula (smFRET), que es una técnica que puede medir distancias entre 1-10 nanómetros dentro de moléculas individuales; en este caso, dentro de las proteínas Htt individuales. Esta parte del estudio produjo la primera evaluación cuantitativa de cómo las distancias interatómicas dentro de Httex1 varían con las mutaciones de expansión.
Finalmente, los científicos trabajaron con el laboratorio de Pappu en la Universidad de Washington, donde desarrolló nuevos enfoques de modelado por computadora para producir físicamente precisos, Modelos estructurales de nivel atómico de Httex1 que mejor se ajustan a todos los datos de una sola molécula de los dos pasos anteriores. Los resultados fueron sorprendentes:la estructura general de Httex1 se asemeja a la de un renacuajo.
El efecto renacuajo
"Arquitectónicamente, Httex1 tiene forma de renacuajo, con una cabeza globular polyQ y una cola flácida, ", Dijo Pappu." A medida que la longitud de polyQ se alarga, la cabeza del renacuajo se agranda en su superficie. Este aumento de la superficie de la cabeza parece engendrar interacciones que de otro modo no deberían estar presentes en las células ".
El descubrimiento desafía las antiguas ideas sobre la acumulación de Httex1 en la enfermedad de Huntington. "Si la hipótesis predominante fuera cierta, "Pappu dijo, "entonces el renacuajo se habría convertido en una 'rana' a medida que la longitud de la poliQ aumenta por encima de la longitud del umbral, pero ese no parece ser el caso. En cambio, los nuevos resultados centran nuestra atención en las nuevas interacciones celulares de ganancia de función que son impulsadas por la estructura del renacuajo con una cabeza polyQ más grande ".
"Si bien la hipótesis predominante ha favorecido un modelo en el que la toxicidad inducida por la huntingtina mutante es impulsada principalmente por su propensión a doblarse mal y agregarse, Nuestros hallazgos sugieren que las interacciones aberrantes a nivel de monómero también pueden contribuir al inicio y / o progresión de la enfermedad. "Dijo Lashuel.
"Este hallazgo nos permite examinar qué regiones de esta proteína son importantes para apuntar, y modular su toxicidad de una manera específica, "dijo Kiersten M. Ruff, un becario postdoctoral en el laboratorio de Pappu que diseñó las simulaciones por computadora y es el co-primer autor del artículo.
El próximo desafío para los científicos es comprender cómo estos cambios estructurales en el nivel de monómero de Httex1 se traducen en una mayor agregación y toxicidad cuando la longitud de la cola de polyQ cruza el umbral patógeno.
"La clave ha sido la centralidad de la colaboración entre tres equipos con experiencia complementaria y no superpuesta, todos compartiendo un compromiso con el avance de la ciencia, "Dijo Lashuel.