Los químicos de la Universidad de Rice han diseñado una metaloproteína enchufable para simplificar la tarea de hacer terapias con anticuerpos dirigidos. Los investigadores utilizaron un péptido triple metalado (recuadro) para dar una función específica a los anticuerpos (violeta) con una ojiva terapéutica. Los anticuerpos modificados se dirigieron selectivamente a la superficie de las células de cáncer de mama en el laboratorio (imagen). Crédito:Ball Research Group / Rice University
Los científicos de la Universidad de Rice han desarrollado un método para modificar de manera eficiente los anticuerpos naturales que pueden administrar medicamentos a las células diana. Agregar un poco de metal adicional es la clave.
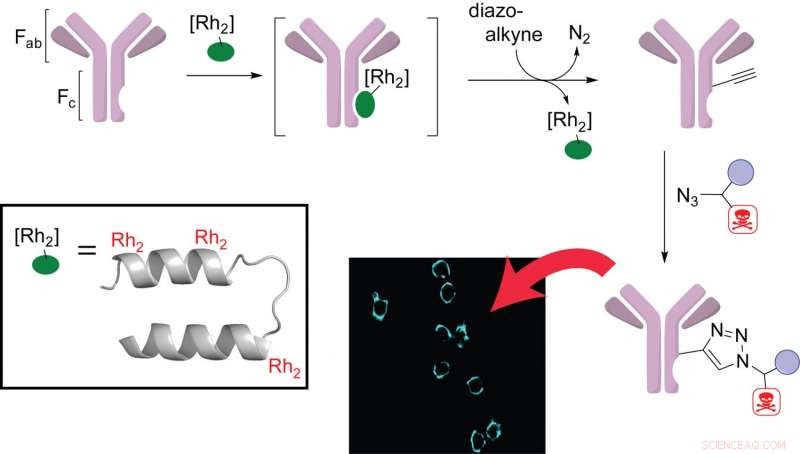
El químico de Rice Zachary Ball y el estudiante de posgrado y autor principal Jun Ohata descubrieron que el rodio, un raro metal de transición, puede ser un elemento útil en el diseño y preparación de conjugados (tratamientos) de anticuerpos y fármacos que se han convertido en una herramienta estándar para la administración dirigida de fármacos como los quimioterápicos.
Desarrollaron una proteína multimetálica única que actúa como una enzima para catalizar la acción de una amplia variedad de anticuerpos. El proceso simple permitirá a los laboratorios probar la función relativa de una variedad de fuentes de anticuerpos y dianas de antígenos para ver cuál funcionará mejor en una célula tumoral.
La investigación aparece en el Revista de la Sociedad Química Estadounidense .
La clave del diseño de Ball y Ohata es tener tres complejos de rodio unidos a sitios específicos de una proteína que se une a la región de anticuerpos constante (Fc). Una vez atado, este péptido multimetálico cataliza la unión específica del sitio de agentes terapéuticos con una mínima alteración del propio anticuerpo. El laboratorio probó sus complejos en células de cáncer de mama y confirmó que los anticuerpos modificados conservaban sus propiedades de unión a antígenos.
"La belleza de este catalizador es que se une a la región constante del anticuerpo, por lo que debería ser general para todos los anticuerpos humanos, "dijo Ball, profesor asociado de química y director del Instituto de Biociencias y Bioingeniería de Rice. "Tenemos un sencillo, sistema de casete universal que se conecta a los anticuerpos para producir conjugados de fármacos con bastante rapidez y facilidad ".

El estudiante graduado de la Universidad de Rice, Jun Ohata, transfiere una muestra de una proteína multimetálica. La proteína de complemento está diseñada para simplificar la tarea de realizar terapias con anticuerpos dirigidos. Crédito:Jeff Fitlow / Rice University
La técnica está destinada a simplificar lo que ha sido un camino complicado hacia los conjugados de anticuerpo y fármaco. "Hacer química selectiva en anticuerpos naturales sin modificar primero sus secuencias ha sido un problema sin resolver, "Dijo Ball." La conjugación puramente aleatoria puede ser valiosa, pero es difícil entender las relaciones estructura-actividad cuando no tienes una estructura única; se obtiene un conjunto de moléculas con un conjunto de propiedades ”. Dijo que los conjugados homogéneos también son más deseables desde una perspectiva reguladora.
Su laboratorio tiene una amplia experiencia con la interacción de proteínas y metales de transición, un grupo de elementos en el centro de la tabla periódica, incluido el rodio, con diversa reactividad química.
Los complejos de rodio en la metaloproteína de Ball y Ohata desempeñan múltiples funciones. "Al menos uno de los complejos de rodio se une y ayuda a orientar el sistema correctamente, y un segundo hace la química de formación de enlaces, "Dijo Ball.
"Es un problema químico fascinante, ", dijo." Hemos resuelto muchos problemas de selectividad de moléculas pequeñas, pero cuando los químicos pasan a sistemas cada vez más grandes, los enfoques tradicionales no son suficientes ".
"Nuestros estudios en el pasado se han centrado en hacer la química para poner algo en las proteínas, pero aquí tuvimos que utilizar las proteínas producidas en más estudios biológicos, que nunca habíamos intentado hacer antes, "Dijo Ohata." Me tomó casi dos años terminar estos experimentos relacionados con la biología ".
"Pensamos en esto como la frontera de la selectividad química, "Dijo Ball." Tenemos esta molécula masiva que pesa 150, 000 kilodaltons. ¿Cómo encontramos un grupo hidroxilo en esa estructura masiva y hacemos química en él? Este es el tipo de cosas fundamentales en las que a los químicos les encanta pensar ".
El laboratorio de Ball está comenzando a trabajar con los colaboradores del Texas Medical Center para probar el nuevo catalizador. "Queremos ponerlos en manos de los médicos y del personal de desarrollo de fármacos para ver qué pueden hacer estos conjugados, " él dijo.