Crédito:HIMS
Los químicos que trabajan en el área prioritaria de investigación de Química Sostenible de la Universidad de Ámsterdam (UvA) han colaborado con el Laboratorio Solvay del Futuro en Burdeos para desarrollar una caja de herramientas práctica para predecir la solubilidad de moléculas pequeñas en diferentes disolventes. Estas herramientas están disponibles de forma gratuita y de acceso abierto. y puede mejorar la selección de disolventes y las formulaciones de muchos productos industriales.
Los solventes son extremadamente importantes para muchos sectores industriales. A menudo, en la formulación de un producto químico, el solvente constituye la mayor parte de la entidad. También es crucial para la función del producto. Por ejemplo, con la formulación de disolvente adecuada, los pesticidas permanecen más tiempo en las hojas después de la lluvia, las pinturas y tintas se secan más rápido, y los cosméticos se aplican con mayor facilidad. Por tanto, conocer la solubilidad de las moléculas es fundamental para el desarrollo de productos.
El problema de las moléculas pequeñas
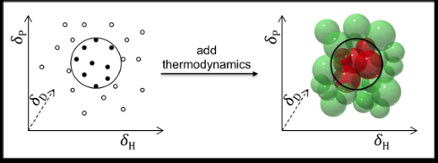
La predicción de la solubilidad se suele realizar utilizando los denominados parámetros de solubilidad de Hansen:dispersión (D), interacciones polares (P), y enlaces de hidrógeno (H). La industria de recubrimientos y polímeros, por ejemplo, obtiene excelentes resultados utilizando estos parámetros para predecir la solubilidad de polímeros.
En principio, Los parámetros de Hansen también se pueden utilizar para encontrar disolventes para moléculas más pequeñas como medicamentos y cosméticos. Pero ahí las predicciones no son tan satisfactorias, por dos razones:una, porque los medicamentos y los cosméticos suelen tener grupos funcionales más variados; y dos, debido a que los parámetros originales de Hansen excluyen las consideraciones termodinámicas con respecto a la mezcla, fusión y disolución. Esto es aceptable para polímeros (donde la termodinámica se cancela) pero no para moléculas pequeñas.
Dr. Manuel Louwerse y Prof. Gadi Rothenberg, trabajando junto con el equipo del Dr. Bernard Roux en Solvay, ahora han mejorado el modelo de Hansen y lo han adaptado para manejar solutos de moléculas pequeñas al incluir la termodinámica de la mezcla, fusión y disolución. Las mejoras se basan en una mejor descripción de los términos de entropía y entalpía. Cuando un compuesto se disuelve, las moléculas salen del cristal y se mezclan con el disolvente. Esto aumenta la entropía, pero normalmente cuesta algo de entalpía. El problema clave aquí es que la cantidad de entropía ganada al mezclar determina cuánta entalpía se puede perder mientras se mantiene un ∆G negativo (en otras palabras, manteniendo la fuerza impulsora de la disolución). Dado que el efecto de la entropía depende de la concentración, la temperatura, y el tamaño de las moléculas, todos estos deben incluirse.
Se realizó otra mejora al dividir las contribuciones de los donantes y aceptores de electrones entre el solvente y el soluto. Esto es especialmente importante para casos como enlaces de hidrógeno, que es relevante para muchos solventes y solutos. El mantra 'como se disuelve como' es demasiado simplista aquí. Se forman enlaces de hidrógeno entre donantes y aceptores, por lo que se necesitan donantes para disolver a los aceptantes, y viceversa. Al dividir las contribuciones de donantes y aceptores de cada solvente y soluto, el equipo de UvA obtuvo modelos más precisos.
Los nuevos modelos son mucho mejores para predecir la solubilidad de moléculas pequeñas en disolventes y mezclas de disolventes. Las pruebas en un gran conjunto de datos industriales de 15 solutos diferentes y 48 disolventes y sus mezclas en el Laboratorio Solvay del Futuro mostraron que las cualidades de ajuste mejoraron de 0,89 a 0,97. El porcentaje de predicciones correctas aumentó del 54% al 78%. Dado que solo adivinar ya produciría un 50% de predicciones correctas, esta es una mejora seria. Otra ventaja importante es que el nuevo modelo permite predicciones a temperaturas extrapoladas.
Los resultados y los modelos se publican como un artículo de acceso abierto en la revista internacional revisada por pares. ChemPhysChem . El documento ya ha suscitado muchos comentarios, y las mejoras ahora se están incorporando a una versión más reciente del software HSPiP.
Si bien la mayoría de los datos reales de formulación industrial son confidenciales, el equipo conjunto ha publicado en acceso abierto la descripción completa de la teoría y los modelos. También incluyeron las rutinas de Matlab completas y anotadas en la información de apoyo, permitiendo que todos utilicen estas nuevas herramientas para diseñar nuevas mezclas y formulaciones de solventes.
El profesor Rothenberg considera que la publicación de herramientas es la clave para el éxito de las asociaciones público-privadas entre la industria y el mundo académico. 'Los socios industriales deben mantener la confidencialidad de sus datos, pero la mayoría de ellos se da cuenta de que la publicación de acceso abierto de los métodos y herramientas crea buena voluntad y permite nuevos desarrollos tanto por parte de los colaboradores como de la competencia. Compartiendo métodos y herramientas, las empresas pueden beneficiarse del conocimiento de las demás sin sacrificar datos ”.