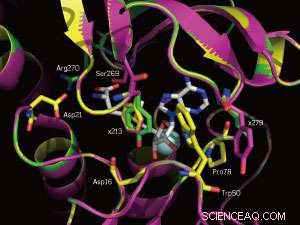
Un primer plano de los sitios de unión a SAM de la enzima nativa (amarillo) y dos mutantes (magenta y verde). Las posiciones mutadas 213 y 279 están marcadas. Crédito:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim
Las moléculas orgánicas que contienen un átomo de flúor se utilizan ampliamente en los materiales, Industrias agroquímicas y farmacéuticas. Sin embargo, la síntesis del enlace carbono-flúor normalmente utiliza catalizadores metálicos tóxicos y requiere condiciones anhidras y altas temperaturas. Ahora, un equipo internacional ha desarrollado una enfoque basado en enzimas más eficiente para crear este enlace.
Este método enzimático funciona en condiciones acuosas y a temperaturas suaves y fue desarrollado por un consorcio que incluyó a investigadores de A * STAR y otras instituciones. "Estas condiciones son realmente muy atractivas, "explica el miembro del equipo Yee Hwee Lim del Instituto A * STAR de Ciencias Químicas e Ingeniería.
El equipo utilizó una de las enzimas fluorinasa altamente específicas que se encuentran en la naturaleza:FlA1. Estas enzimas catalizan la formación de un enlace carbono-flúor en S-adenosilmetionina (SAM) utilizando fluoruro inorgánico mediante un mecanismo de sustitución.
La enzima si bien es excelente para catalizar reacciones de fluoración con esta molécula natural, no funcionó bien en moléculas no naturales. Es más, esfuerzos para modificar las estructuras de las enzimas y, por lo tanto, la función había sido una lucha, hasta ahora.
"Demostramos por primera vez que la enzima fluorinasa se puede diseñar, y que la ingeniería puede mejorar su actividad enzimática incluso en moléculas no naturales, "Lim dice.
El equipo utilizó la técnica establecida conocida como 'evolución dirigida' que imita la selección natural para desarrollar enzimas para que puedan reaccionar bien con moléculas no naturales.
"La evolución dirigida nunca se ha aplicado con éxito a esta enzima, hasta ahora, ", dice Lim." Es una enzima difícil de trabajar y enfrentamos muchos desafíos, incluidos problemas con la degradación del producto ".
El equipo utilizó el radiomarcaje de 5'-cloro-5'-desoxiadenosina (5'-CIDA) para mostrar sus capacidades. En esta reacción de dos pasos, 5'-CIDA radiomarcado se convierte en SAM, y luego fluorada para formar 5'-fluoro-5'-desoxiadenosina (5'-FDA). Este producto etiquetado como 5'-FDA podría potencialmente usarse para un procedimiento de diagnóstico médico conocido como tomografía por emisión de positrones (PET).
"Demostramos que mejorar tres veces la actividad de una enzima puede abrir más aplicaciones, ", dice Lim." Las enzimas nativas se han utilizado anteriormente para probar y etiquetar los agentes de PET, pero los tiempos de reacción fueron largos, a veces horas. Usando nuestra enzima podríamos hacer la reacción en 30 minutos, una línea de tiempo más razonable dado que la vida media del flúor-18 es menos de dos horas ".
El equipo de Lim ahora está explorando cómo la mutación de la estructura de la enzima cambia su interacción con 5'-CIDA y SAM. "Me gustaría involucrar a los biólogos computacionales para comprender mejor las mutaciones que hemos hecho y cómo se correlacionan con nuestras reacciones".