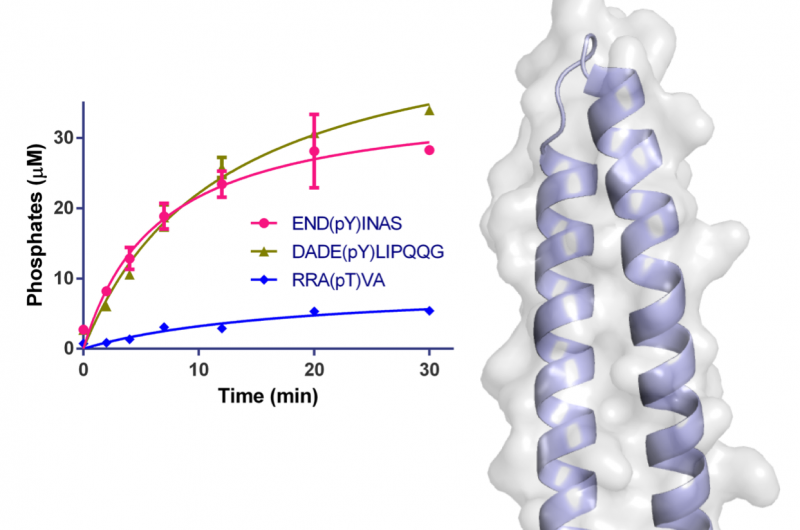
Figura 1:Estructura de WipA en dibujos animados y representación de superficie semitransparente. El dominio de la fosfatasa se representa en rojo-verde y la espiral adjunta en azul claro. Los residuos involucrados en la catálisis se representan como barras alrededor de los iones Mn2 + y fosfato. La superficie se muestra en gris claro. El gráfico de inserción muestra la desfosforilación en el tiempo de péptidos específicos usando 20 nM de WipA. Crédito:Fuente de luz de diamante
Científicos con sede en Londres han dilucidado la estructura de un gran fragmento de una proteína bacteriana, conocido como WipA, que es secretada por Legionella pneumophila. La obra, publicado recientemente en el Revista de química biológica , demostró que la proteína poseía algunas características fascinantes que daban información valiosa sobre su mecanismo de acción.
La bacteria L. pneumophila, provoca una forma grave de neumonía conocida como enfermedad del legionario. La patogenicidad de esta bacteria depende de la secreción de más de 300 proteínas efectoras en el huésped. Uno de esos efectores, WipA, llamó la atención por su dependencia de un complejo chaperón (necesario para asegurar la funcionalidad de las proteínas) para su secreción y su papel desconocido en la patogenicidad.
Se utilizaron dos de las líneas de luz de Cristalografía Macromolecular (MX) (I02 e I04) en Diamond Light Source para iniciar el estudio y resolver la estructura cristalina de un gran fragmento de WipA. La estructura mostró que la proteína poseía un pliegue de serina / treonina fosfatasa que sorprendentemente se dirigía a los péptidos fosforilados en tirosina. Adicionalmente, Se planteó la hipótesis de que WipA podría pasar de un estado homodimérico a un estado heterodimérico para interactuar con una diana huésped fosforilada en tirosina. Los descubrimientos ayudarán a aclarar los mecanismos moleculares que sustentan la patogenicidad de Legionella y podrían ayudar al desarrollo de inhibidores.
Vapor infectado
La enfermedad del legionario puede ser letal entre los miembros vulnerables de una población, y es particularmente peligroso durante los brotes hospitalarios. Una de las principales fuentes de infección por Legionella es el vapor de agua en los sistemas de aire acondicionado, calderas, baños y duchas calientes.
Una vez que un huésped inhala el vapor infectado, las bacterias ingresan a los pulmones y buscan glóbulos blancos, conocidos como macrófagos. Las bacterias quedan engullidas por los macrófagos, pero en lugar de ser asesinado por ellos, las bacterias emplean hábilmente un sistema de secreción de tipo IVb para secretar una gran variedad de proteínas efectoras en la célula huésped con el fin de secuestrar la maquinaria celular del huésped y asegurar la supervivencia bacteriana.
Amplia selección
El fragmento principal de WipA se cristalizó con éxito eliminando ambos extremos de la secuencia que predijo regiones no estructuradas. Los cristales se analizaron inicialmente en las líneas de luz I02 e I04 de Diamond, mientras que el trabajo se completó en la línea de luz PetraIII P13 en el Laboratorio Europeo de Biología Molecular en Hamburgo.
En Diamond, la línea de luz Microfocus MX (I04) se usó para el cribado de cristales y I02 se usó para recolectar datos de difracción. El Dr. Nikos Pinotsis es un investigador postdoctoral en biología estructural y molecular en el laboratorio del profesor Gabriel Waksman en el Instituto de Biología Estructural y Molecular de Birkbeck / UCL y co-investigador del estudio. Explicó su enfoque, "Aunque el tamaño de los cristales de WipA era suficiente para los experimentos de difracción de monocristales, la mayoría de ellos mostraban celosías múltiples y / o desordenadas, por lo tanto, la detección exhaustiva fue fundamental para adquirir con éxito datos de alta resolución y calidad. Optimizamos nuestras estrategias de recopilación de datos a un tamaño de haz que se ajustaba suficientemente a la más corta de las dimensiones del cristal y optimizamos el haz maximizando el tiempo de exposición y el haz y minimizando el daño por radiación ".
Primero de su clase
La estructura del fragmento WipA exhibía un pliegue de fosfatasa montado en una horquilla helicoidal, que fue el primero de su clase. El núcleo de esta estructura se asemejaba a una proteína fosfatasa de serina / treonina, pero los experimentos bioquímicos mostraron inesperadamente que tenía preferencia por los sustratos fosforilados en tirosina. Esta sorprendente observación solo se había observado una vez antes entre varios cientos de fosfatasas similares.
El Dr. Pinotsis explicó la relevancia de los hallazgos:"Una vez que se conoce el objetivo del huésped para la desfosforilación por WipA, podrían diseñarse inhibidores para inhibir esa interacción. Si bien es posible que estos hallazgos conduzcan al diseño de antibacterianos, principalmente contribuyen a una comprensión general de la supervivencia y patogenicidad de una bacteria, que es un primer paso muy importante para establecer tratamientos duraderos contra las infecciones ".
El equipo planea identificar el objetivo de WipA dentro de las células huésped y continuará explorando más interacciones proteína-proteína para proporcionar una visión más completa del mecanismo de infección de Legionella.