Figura 1. La estructura en forma de cinta del complejo del fotosistema II (ID de PDB:3ARC). Crédito:Universidad de Kobe
La fotosíntesis requiere un mecanismo para producir grandes cantidades de energía química sin perder el poder oxidativo necesario para descomponer el agua. Un equipo de investigación japonés ha aclarado parte de este mecanismo, marcando un paso más hacia el desarrollo potencial de la fotosíntesis artificial. Los hallazgos fueron publicados el 27 de febrero en la edición en línea de la Revista de letras de química física .
El equipo fue dirigido por el profesor KOBORI Yasuhiro (Centro de Investigación de Fotosciencia Molecular de la Universidad de Kobe) y el estudiante de doctorado HASEGAWA Masashi (Escuela de Graduados en Ciencias) con el Profesor Asociado MINO Hiroyuki (Escuela de Graduados de Ciencias de la Universidad de Nagoya).
Durante la reacción de división del agua en la fotosíntesis, las plantas producen oxígeno al convertir la energía solar en energía química, proporcionando la fuente de energía necesaria para su supervivencia. Esta reacción la lleva a cabo un complejo proteico en los cloroplastos (ubicado en las hojas) llamado complejo del fotosistema II (ver figura 1).
En 2015, el equipo de investigación del profesor Kobori logró analizar las interacciones electrónicas y la ubicación tridimensional de la separación de carga inicial producida directamente después de la fotorreacción en el centro de reacción fotosintética de las bacterias púrpuras. que no provocan el potencial de oxidación para la disociación del agua. Sin embargo, en el complejo fotosistema II para plantas superiores, la configuración del estado de separación de carga inicial no estaba clara, y era un misterio cómo condujo a una reacción eficaz de división del agua mientras conservaba el alto poder oxidativo.
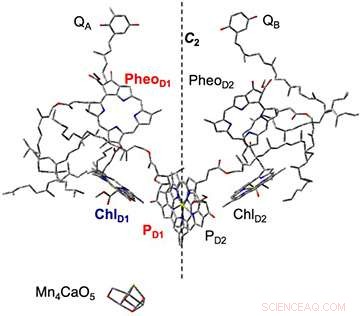
Figura 2. La composición de las moléculas de pigmento en el centro de la reacción del complejo del fotosistema II, aclarado por análisis estructural de rayos X. Basado en el proceso de separación de carga inicial, se produce una carga negativa en la feofitina (PheoD1) y una carga positiva en la clorofila (PD1). Esta vez la plastoquinona (QA, QB) fue prerreducido:se irradiaron las muestras de membrana tilacoide en las que se había suspendido la transferencia de electrones de feofitina, y se capturó el estado de separación de carga (PheoD1- ・ PD1 + ・). Mn4CaO5 se oxida a partir de PD1 + ・ y sirve como catalizador para la división del agua. Crédito:Universidad de Kobe
Los científicos extrajeron membranas de tilacoides (donde tiene lugar la fotorreacción en la fotosíntesis) de espinacas, añadió un agente reductor, e irradió las muestras. Esto les permitió detectar señales de microondas desde el estado de separación de carga inicial con un grado de precisión de una 10 millonésima de segundo (ver figura 3a). Desarrollaron un método para analizar las señales de microondas utilizando imágenes de polarización de espín. Por primera vez fue posible realizar un análisis de vista 3D de la configuración de la carga eléctrica producida directamente después de la exposición a la luz como intermedio reactivo. Esto se hizo con una precisión de 10 millonésimas de segundo, como fotografía consecutiva (ver figura 3b). Basado en esta visualización, también cuantificaron la interacción electrónica que ocurre cuando las órbitas de los electrones se superponen para moléculas con cargas eléctricas (figura 3c).
La estructura de separación de carga eléctrica inicial aclarada por este análisis no era muy diferente de la estructura antes de la reacción. pero el análisis de imágenes mostró que la carga eléctrica positiva que se produjo en el pigmento como un intermedio reactivo existía desproporcionadamente en moléculas individuales de clorofila (figura 3b, C). Sugiere que existe una fuerte estabilización causada por la interacción electrostática entre las cargas.
Se ha revelado que se suprime el retorno de la carga negativa, dado que la superposición entre las órbitas de los electrones está muy limitada por el efecto aislante del extremo del grupo vinilo. Esto significa que es posible utilizar los altos poderes oxidantes de la carga positiva en la clorofila (PD1) para la posterior descomposición oxidativa del agua.
Con base en estos hallazgos, Los investigadores han desbloqueado parte del mecanismo para producir de manera efectiva grandes cantidades de energía química sin perder el poder oxidativo necesario para dividir el agua en la fotosíntesis. Estos hallazgos podrían ayudar a diseñar un "sistema de fotosíntesis artificial" que pueda proporcionar una fuente de energía limpia mediante la conversión eficiente de la energía solar en grandes cantidades de electricidad e hidrógeno. La aplicación de este principio podría contribuir a resolver problemas con energía, el medio ambiente y la escasez de alimentos.
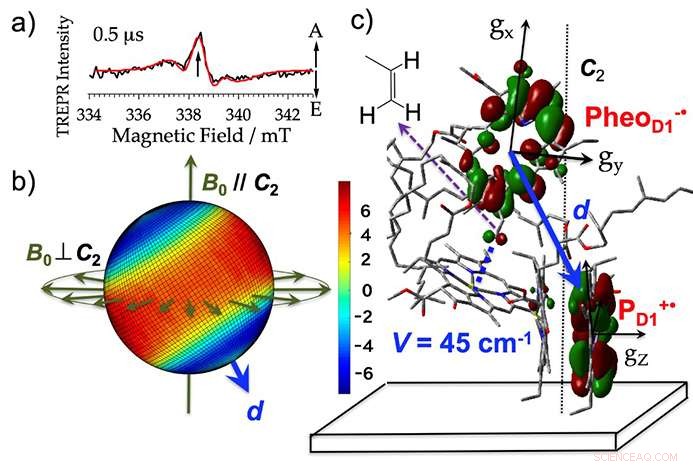
Figura 3. a) El espectro para el complejo del fotosistema II obtenido mediante resonancia paramagnética electrónica de resolución temporal (TREPR). A y E muestran las señales de microondas para absorción y emisión (polarización de espín de electrones). b) La formación de imágenes en 3D de (a) la polarización del espín del electrón mapeada en todas las direcciones posibles del campo magnético con una intensidad de campo magnético de resonancia de 338,3 mT. El rojo y el azul muestran respectivamente la fuerza de absorción y emisión del microondas. Para las muestras donde la película está alineada con el eje de la membrana tilacoide, los cambios de señal obtenidos cuando la dirección del campo magnético externo (B0) con respecto a la dirección normal del plano de la película (C2) son paralelas (B0 // C2) y perpendiculares (B0⊥C2) apoyan esta imagen tridimensional. d muestra el vector direccional que vincula las cargas eléctricas. c) La ubicación orbital del estado de separación de carga eléctrica inicial (PheoD1- ・ PD1 + ・) en el centro de reacción. Crédito:Universidad de Kobe