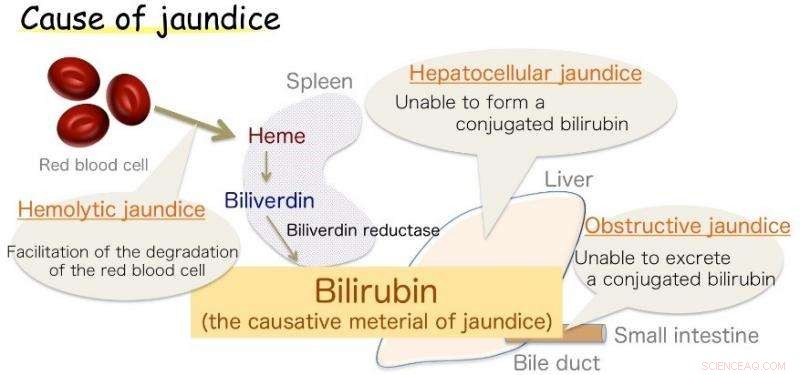
Fig.1:Causa de ictericia. La bilirrubina es el material causante de la ictericia. Crédito:Universidad de Osaka
Un equipo de investigación japonés que involucra a la Universidad de Osaka investigó la biliverdina reductasa, la enzima que produce bilirrubina, una sustancia relacionada con la ictericia, a partir de la biliverdina (BV). Se encontraron dos moléculas de BV en el sitio de reacción de la enzima, en una disposición apilada inusual. Los experimentos de mutación confirmaron qué aminoácido enzimático era necesario para la producción de bilirrubina. En el mecanismo propuesto, este aminoácido transfiere hidrógeno a una molécula de BV, utilizando el otro BV como conducto. Esto ayuda a la búsqueda de medicamentos contra la ictericia.
Osaka - ictericia, marcado por la coloración amarillenta de la piel, es común en los bebés, pero también un síntoma de diversas enfermedades de los adultos. Esta decoloración es causada por un exceso de bilirrubina (BR), la sustancia que le da a la bilis su tinte amarillo. Sin embargo, BR también es un antioxidante vital, que en niveles saludables protege las células contra el daño del peróxido. Su producción en el cuerpo, aunque, ha sido durante mucho tiempo una fuente de incertidumbre.
Ahora, una colaboración de investigación japonesa que involucra a la Universidad de Osaka cree que tiene la respuesta. Ya se sabe que el BR se produce a partir de una sustancia química relacionada, biliverdina (BV), por la enzima biliverdina reductasa (BVR). La enzima envuelve BV y transfiere dos átomos de hidrógeno, uno positivo y otro negativo, para producir el antioxidante amarillo. Sin embargo, los biólogos no pudieron establecer qué parte de la enzima estaba químicamente involucrada en el proceso (el sitio activo), o de donde vino el hidrógeno positivo. Los hallazgos se informaron recientemente en Comunicaciones de la naturaleza .
"Estudios anteriores utilizaron BVR de ratas, y nunca podría cristalizar la enzima lo suficientemente bien como para determinar cómo se une a BV, ", dice el coautor del estudio, Keiichi Fukuyama." Nos dimos cuenta de que la misma enzima en la bacteria Synechocystis tenía una forma de pliegue casi idéntica, pero fue más fácil de examinar mediante cristalografía de rayos X ".
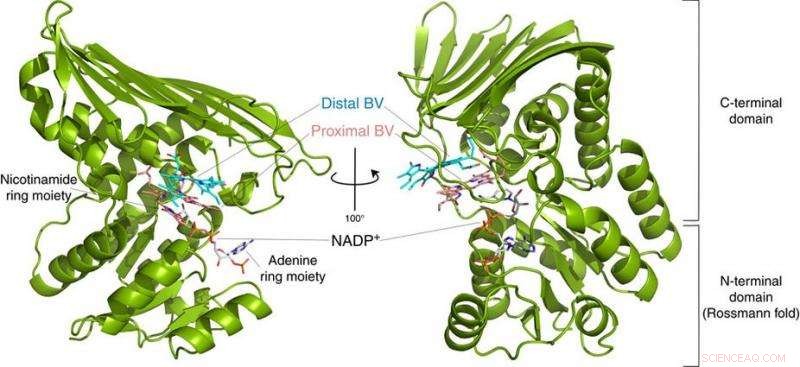
Fig.2:Estructura de BVR. Esta estructura reveló que BVR se une a dos sustratos de biliverdina (Distal BV y Proximal BV) al mismo tiempo. Crédito:Universidad de Osaka
Para su sorpresa, los investigadores encontraron dos moléculas de BV, una apilada sobre la otra, en el sitio activo, aunque solo uno se convierte a BR. De los datos de rayos X, dedujeron por qué se necesitaban dos. El primer BV, debido a la dirección en la que mira para recibir el hidrógeno negativo, no puede aceptar el hidrógeno positivo directamente de la enzima. En lugar de, el segundo BV actúa como un conducto de hidrógeno para permitir el proceso, pero no se convierte en BR.
De la estructura, los investigadores propusieron cuál de los 328 aminoácidos de la enzima proporciona realmente el átomo de hidrógeno positivo. Luego, realizaron experimentos en los que se mutaron las enzimas para eliminar específicamente ese aminoácido, dejando los demás intactos. Las enzimas resultantes, ya sea de bacterias, ratas o humanos, fueron virtualmente incapaces de producir BR. Otros experimentos confirmaron que las enzimas de rata y humana también usaban dos moléculas de BV, al igual que las bacterias.
"Un apilamiento tan ordenado de dos moléculas de sustrato durante los procesos enzimáticos es muy raro, "Dice Fukuyama." Una mejor comprensión de la producción de BR no solo es emocionante para la bioquímica, pero debería ayudarnos a desarrollar medicamentos para enfermedades marcadas por ictericia severa por exceso de BR, como la hepatitis ".
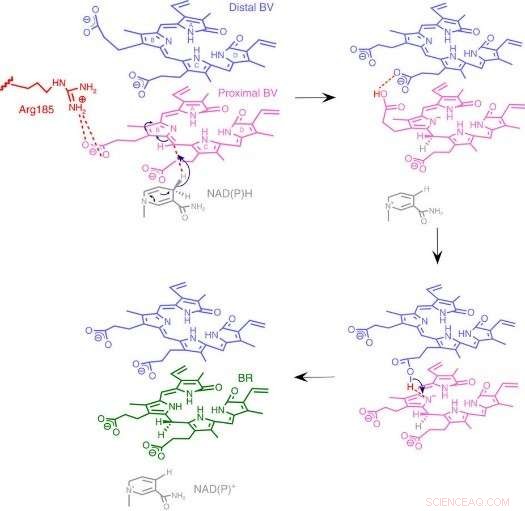
Fig.3:Mecanismo de la reacción BVR. Proponemos un mecanismo de reacción único basado en una estructura enzimática novedosa en la que dos sustratos apilados se unen a un bolsillo catalítico. Crédito:Universidad de Osaka