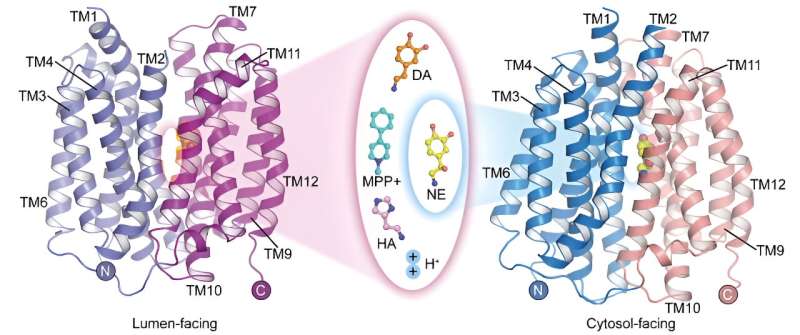
El transportador vesicular de monoaminas 2 (VMAT2) es la única proteína transportadora en el sistema nervioso central que media en el almacenamiento de neurotransmisores monoaminas. Desempeña un papel fundamental en la mediación de la transmisión de impulsos nerviosos y la neuroprotección.
Actualmente, los mecanismos por los cuales VMAT2 reconoce y transporta varios neurotransmisores monoamino estructuralmente diferentes y el inductor de la enfermedad de Parkinson MPP + no están claros y también es necesario explorar más a fondo el mecanismo molecular del transporte de sustrato acoplado a protones.
En un estudio publicado en Cell Research El 22 de mayo, un equipo de investigación dirigido por el Prof. Zhao Yan del Instituto de Biofísica de la Academia China de Ciencias (CAS), en colaboración con el Prof. Jiang Daohua del Instituto de Física de la CAS, informó sobre la estructura apo del ser humano. transportador vesicular de monoamina 2 (hVMAT2) a pH bajo, las estructuras complejas de las vesículas enfrentadas a la dopamina, la noradrenalina, la histamina y la neurotoxina MPP + unión y la compleja estructura de unión de norepinefrina en el estado de cara al citosol.
Estas estructuras revelan la base estructural del reconocimiento del sustrato VMAT2 y refinan aún más el mecanismo molecular del transporte de sustrato acoplado a protones.
Aunque la noradrenalina, la dopamina, la serotonina y el MPP + tienen diferentes estructuras moleculares, las estructuras complejas de la unión de VMAT2 a estos sustratos muestran que todos se unen a posiciones similares en la proteína transportadora. Sin embargo, diferencias sutiles en ciertos grupos funcionales de estos sustratos conducen a diferencias significativas y críticas en sus interacciones y modos de unión con la proteína transportadora. Estas diferencias ilustran cómo VMAT2 reconoce eficientemente diferentes moléculas de sustrato.
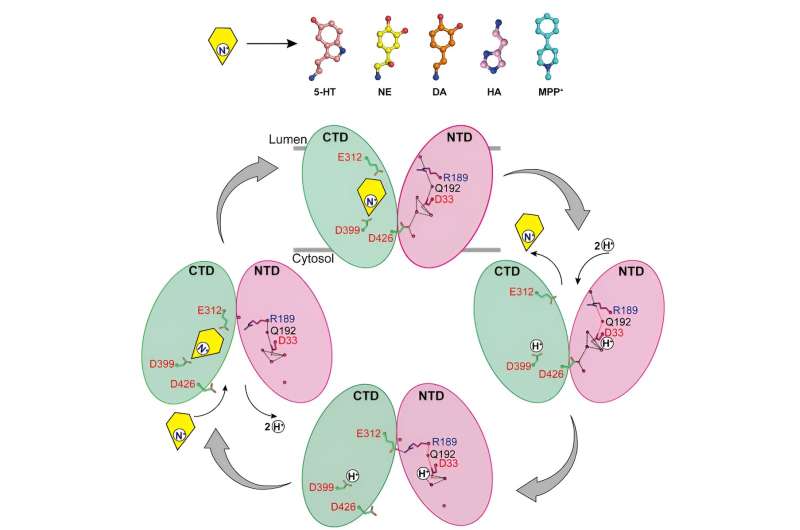
Los investigadores informaron sobre las estructuras de unión de la norepinefrina a VMAT2 en diferentes conformaciones, incluidas las conformaciones orientadas al citosol y a las vesículas.
A pesar de los cambios conformacionales significativos en VMAT2, la bolsa de unión al sustrato de la norepinefrina permanece relativamente estable durante este proceso, sin cambios significativos en las interacciones con los residuos circundantes. Esta inteligente transición conformacional es crucial para el funcionamiento de VMAT2.
Al analizar las estructuras de VMAT2 en diferentes condiciones de pH, se confirmó que D33 puede ser otro sitio clave de protonación.
Al analizar exhaustivamente los mecanismos por los cuales VMAT2 reconoce diferentes neurotransmisores monoamino y neurotoxinas estructuralmente diversos, este trabajo propone un modelo molecular para los cambios conformacionales de VMAT2 y refina aún más el mecanismo específico del transporte de sustrato acoplado a protones.
Estos hallazgos proporcionan información valiosa para una comprensión integral del modo de transporte VMAT2, enriquecen el sistema de conocimiento del transporte de sustrato de la superfamilia de facilitadores principales y sientan una base importante para el desarrollo y la optimización de fármacos.
Más información: Di Wu et al, Las instantáneas estructurales del VMAT2 humano revelan conocimientos sobre el reconocimiento de sustratos y el mecanismo de acoplamiento de protones, Cell Research (2024). DOI:10.1038/s41422-024-00974-9
Información de la revista: Investigación celular
Proporcionado por la Academia China de Ciencias