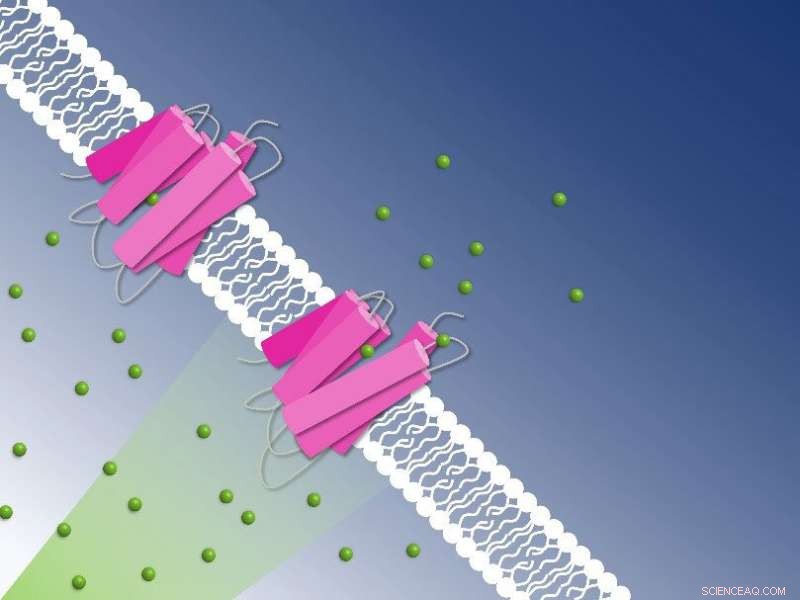
Bombeo de cloruro fotoactivo a través de la membrana celular capturado por cristalografía en serie de resolución temporal:los iones de cloruro (esferas verdes) son transportados a través de la membrana celular por la bomba de cloruro NmHR (rosa). Crédito:Guillaume Gotthard y Sandra Mous
Muchas bacterias y algas unicelulares tienen bombas impulsadas por la luz en sus membranas celulares:proteínas que cambian de forma cuando se exponen a fotones para que puedan transportar átomos cargados dentro o fuera de la célula. Gracias a estas bombas, sus dueños unicelulares pueden ajustarse al valor de pH o salinidad del ambiente.
Una de esas bacterias es Nonlabens marinus, descubierta por primera vez en 2012 en el Océano Pacífico. Entre otros, posee una proteína rodopsina en su membrana celular que transporta aniones cloruro desde el exterior de la célula hacia su interior. Al igual que en el ojo humano, una molécula de retina unida a la proteína se isomeriza cuando se expone a la luz. Esta isomerización inicia el proceso de bombeo. Los investigadores ahora obtuvieron información detallada sobre cómo funciona la bomba de cloruro en Nonlabens marinus.
El estudio fue dirigido por Przemyslaw Nogly, una vez un postdoctorado en PSI y ahora un miembro de Ambizione y líder de grupo en ETH Zürich. Con su equipo, combinó experimentos en dos de las instalaciones de investigación a gran escala de PSI, Swiss Light Source SLS y el láser de electrones libres de rayos X SwissFEL. Las dinámicas más lentas en el rango de milisegundos se investigaron a través de cristalografía en serie resuelta en el tiempo en SLS, mientras que los eventos más rápidos, de hasta picosegundos, se capturaron en SwissFEL; luego, ambos conjuntos de datos se combinaron.
"En un artículo, aprovechamos las ventajas de dos instalaciones de última generación para contar la historia completa de esta bomba de cloruro", dice Nogly. Jörg Standfuss, coautor del estudio que creó un equipo de PSI dedicado a crear tales películas moleculares, agrega que "esta combinación permite una investigación biológica de primera clase como solo sería posible en muy pocos lugares del mundo además de PSI".

Los cristales rosados revelan el mecanismo de transporte de cloruro sobre la membrana celular:utilizando cristalografía en serie de resolución temporal, los cristales rosados de NmHR revelaron sitios de unión de iones en el transportador de cloruro y la dinámica de bombeo después de la fotoactivación. Esto permitió a los investigadores descifrar el mecanismo de transporte de cloruro. Crédito:Sandra Mous
Sin reflujo
Como ha revelado el estudio, el anión cloruro es atraído por un parche cargado positivamente de la proteína rodopsina en la membrana celular de Nonlabens marinus. Aquí, el anión ingresa a la proteína y finalmente se une a una carga positiva en la molécula retinal en el interior. Cuando la retina se isomeriza debido a la exposición a la luz y se voltea, arrastra el anión cloruro y lo transporta un poco más dentro de la proteína. "Así es como la energía de la luz se convierte directamente en energía cinética, desencadenando el primer paso del transporte de iones", dice Sandra Mous, Ph.D. estudiante del grupo de Nogly y primer autor del artículo.
Al estar ahora del otro lado de la molécula retinal, el ion cloruro ha llegado a un punto sin retorno. Desde aquí, solo va más adentro de la celda. Una hélice de aminoácidos también se relaja cuando el cloruro se mueve, obstruyendo además el paso hacia el exterior. "Durante el transporte, dos puertas moleculares aseguran que el cloruro solo se mueva en una dirección:adentro", dice Nogly. Un proceso de bombeo en total toma alrededor de 100 milisegundos.
Hace dos años, Jörg Standfuss, Przemyslaw Nogly y su equipo desentrañaron el mecanismo de otra bomba bacteriana impulsada por la luz:la bomba de sodio de Krokinobacter eikastus. Los investigadores están ansiosos por descubrir los detalles de las bombas impulsadas por la luz porque estas proteínas son herramientas optogenéticas valiosas:diseñadas genéticamente en neuronas de mamíferos, hacen posible controlar las actividades de las neuronas mediante la luz y, por lo tanto, investigar su función.