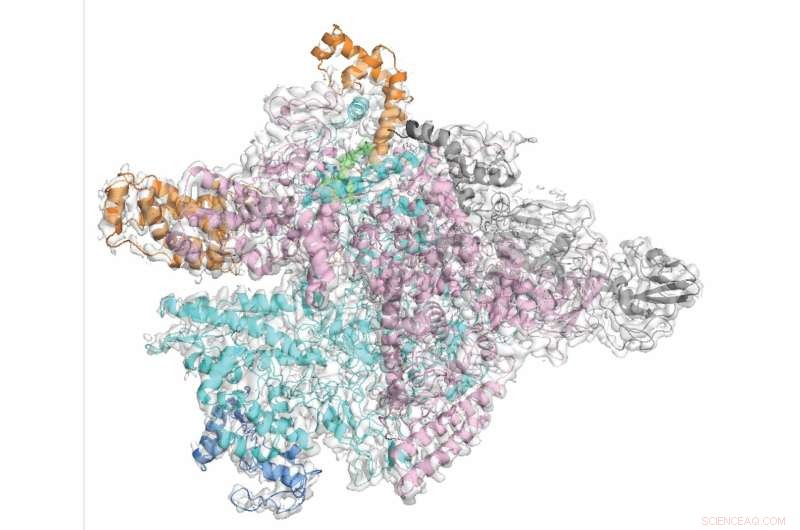
Los investigadores demostraron a nivel molecular cómo la fidaxomicina se dirige selectivamente a C. diff mientras evita a los transeúntes bacterianos inocentes. Crédito:Universidad Rockefeller
La mayoría de los antibióticos son espadas de doble filo. Además de matar al patógeno para el que se prescriben, también diezman las bacterias beneficiosas y cambian la composición del microbioma intestinal. Como resultado, los pacientes se vuelven más propensos a la reinfección y es más probable que surjan cepas resistentes a los medicamentos.
La respuesta a este problema podría ser antibióticos de espectro reducido que maten solo una o unas pocas especies de bacterias, minimizando el riesgo de daños colaterales. En un estudio reciente, los científicos de Rockefeller observaron de cerca uno de esos antibióticos, la fidaxomicina, utilizada para tratar Clostridium difficile, o C. diff, una de las infecciones más comunes asociadas a la atención médica. Los investigadores demostraron a nivel molecular cómo la fidaxomicina se dirige selectivamente a C. diff mientras evita a los transeúntes bacterianos inocentes.
Los hallazgos, detallados en Nature , podría ayudar a los científicos en la carrera por desarrollar nuevos antibióticos de espectro reducido contra otros patógenos.
"Quiero que las personas, los científicos y los médicos piensen de manera diferente sobre los antibióticos", dice Elizabeth Campbell, profesora asociada de investigación en Rockefeller. "Dado que nuestro microbioma es crucial para la salud, los enfoques de espectro reducido tienen un papel importante que desempeñar en la forma en que tratamos las infecciones bacterianas en el futuro".
Enigmáticamente selectiva
C. diff es una bacteria productora de toxinas que puede inflamar el colon y causar diarrea severa. Infecta a alrededor de medio millón de personas en los Estados Unidos, la mayoría en un entorno hospitalario, y aproximadamente uno de cada 11 de los mayores de 65 años que mueren dentro de un mes.
Durante años, los médicos han usado antibióticos de amplio espectro para tratar C. diff. La fidaxomicina es una alternativa relativamente nueva que recibió la aprobación de la FDA en 2011.
Al igual que varios otros antibióticos, incluido el medicamento contra la tuberculosis rifampicina, la fidaxomicina se dirige a una enzima llamada ARN polimerasa (RNAP), que la bacteria usa para transcribir su código de ADN en ARN. Para entender exactamente por qué la fidaxomicina inhibe selectivamente el RNAP en C. diff y no en la mayoría de las otras bacterias, Campbell se asoció con el bioquímico Robert Landick de la Universidad de Wisconsin-Madison para visualizar el RNAP de C. diff usando microscopía crioelectrónica, una poderosa técnica de imagen que puede revelar la forma 3D de las moléculas y capturar la molécula del fármaco y su objetivo en acción. "Aunque la arquitectura general de RNAP en diversas bacterias es similar, aún existen diferencias considerables", dice Campbell.
Espionaje de RNAP
Sin embargo, un gran desafío fue producir primero grandes cantidades de C. diff, un germen anaeróbico que no crece en presencia de oxígeno. El primer autor del estudio, Xinyun Cao, del Landick Lab, dedicó dos años a desarrollar un sistema para producir RNAP de C. diff más fácilmente usando E. Coli, una bacteria de fácil crecimiento que se usa con frecuencia en el laboratorio.
Usando este material, el coautor Hande Boyaci, un postdoctorado en el equipo de Campbell, generó imágenes de C. diff RNAP bloqueadas con fidaxomicina a una resolución casi atómica. Atrapada en una bisagra entre dos subunidades de RNAP, la fidaxomicina abre la pinza de la enzima, evitando que se agarre al material genético y comience el proceso de transcripción.
Al examinar de cerca los puntos de contacto entre la RNAP y la fidaxomicina, los investigadores identificaron un aminoácido en la RNAP que se une a la fidaxomicina pero que está ausente en los principales grupos de microbios intestinales que no se ven afectados por la fidaxomicina. Una versión alterada genéticamente de C. diff que carecía de este aminoácido no se vio afectada por la fidaxomicina, al igual que otras bacterias comensales en el intestino. Por el contrario, las bacterias a las que se les agregó a su RNAP se volvieron sensibles a la fidaxomicina.
Los hallazgos sugieren que este aminoácido entre los 4000 aminoácidos de esta robusta y esencial máquina de transcripción es su talón de Aquiles, responsable de la destrucción de bacterias por la fidaxomicina.
El enfoque utilizado en este estudio propone una hoja de ruta para desarrollar antibióticos nuevos y más seguros, dicen los investigadores. Al dilucidar aún más la estructura RNAP de diversas bacterias, los científicos pueden diseñar antibióticos que se dirijan a cada patógeno de manera más selectiva y efectiva.