Gráficamente abstracto. Crédito:célula molecular (2022). DOI:10.1016/j.molcel.2022.06.024
Publicado en el Molecular Cell journal el 19 de julio, un estudio de investigación del Laboratorio Hatters mostró que la agregación inadecuada de proteínas está relacionada con resultados deficientes para la salud y la supervivencia de las células, especialmente en las neuronas con enfermedades neurodegenerativas.
El estudio investigó las fuerzas motrices moleculares que hacen que las proteínas mal plegadas se unan de manera anormal y analizó el impacto de las proteínas adhesivas en las proteínas circundantes en una célula, específicamente cómo los sistemas de proteostasis detectan estas proteínas adhesivas para evitar que se agreguen.
La investigación es el resultado de una colaboración entre el profesor Rohit Pappu de la Universidad de Washington, investigadores de la Universidad de Melbourne, incluido el Ph.D. estudiante e igual primer autor, Yoon Hee Choi, el profesor David Ascher, la Dra. Dezerae Cox y Angelique Haynes e investigadores de la Universidad de Leeds.
"Descubrimos que había proteínas particulares que normalmente regulan el plegamiento de proteínas, llamadas chaperonas moleculares, que son muy específicas para detectar patrones de pegatinas particulares. Este es un hallazgo importante, ya que informa cómo las células detectan cuando las proteínas se agregan de manera anormal", dijo el profesor Hatters. /P>
Las proteínas son fundamentales para el funcionamiento de las células y la supervivencia y proliferación celular requiere proteínas para plegarse y unirse a otras proteínas.
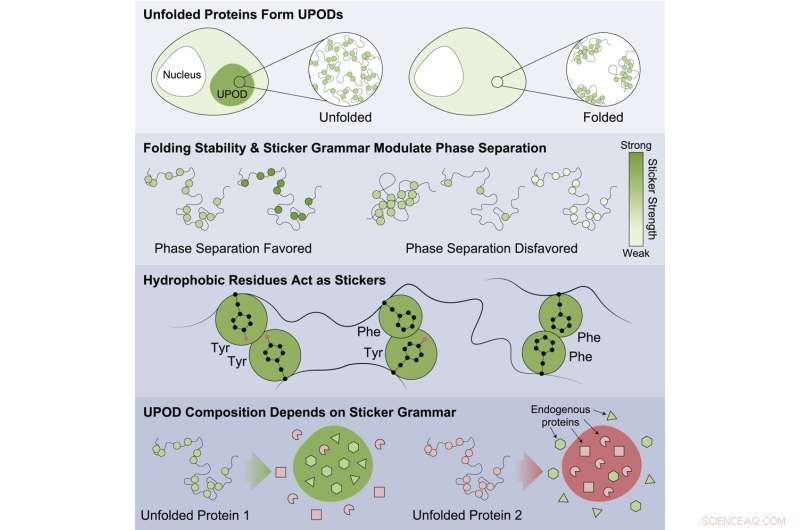
"Cuando las proteínas no se pliegan correctamente, las formas intermedias 'mal plegadas', conocidas como depósitos de proteínas desplegadas (UPOD, por sus siglas en inglés), pueden unirse en agregados. Dichos agregados surgen en muchos entornos de enfermedades, cuando los sistemas moleculares que gobiernan el plegamiento de proteínas y la 'proteostasis de eliminación' ' romper", dijo Choi.
El estudio destacó que las proteínas que eran menos estables tenían más probabilidades de agregarse y asociarse con enfermedades. Los hallazgos sugieren que esto se hace mediante la agregación inapropiada de formularios mal plegados con diferentes subunidades que detectan diferentes códigos de "pegatina" que dirigen la agregación. Las proteínas están involucradas en una gran cantidad de enfermedades, incluidos cánceres, trastornos congénitos, enfermedades del sistema nervioso, trastornos del metabolismo y enfermedades de la piel.
Se encontraron patrones específicos de adhesivos que eran importantes para la agregación directa y que provocaban que otras proteínas transeúntes circundantes en la célula se coagregaran. El trabajo mostró que ciertas clases de aminoácidos eran los mejores adhesivos (tirosina y fenilalanina) y que el patrón de los aminoácidos era importante para saber cómo las proteínas transeúntes se coagregaban de manera inapropiada y cómo las chaperonas moleculares reconocían los agregados que se formaban.
"El siguiente paso es comprender mejor los mecanismos de esto. Esto puede ser útil en los esfuerzos futuros para reprogramar las células para eliminar mejor los agregados de proteínas, como en las enfermedades en las que se acumulan mucho", dijo el profesor Hatters.