Crédito:grupo Pekka Lappalainen
Las leishmanias son parásitos protozoarios flagelados que dependen tanto de los flebótomos como de los mamíferos. Las especies de Leishmania causan enfermedades graves, especialmente en los países tropicales. Debido a su peculiar ciclo de vida y sus más de mil millones de años de distancia evolutiva de los humanos, la biología celular de los parásitos Leishmania presenta diferencias notables en comparación con las células humanas.
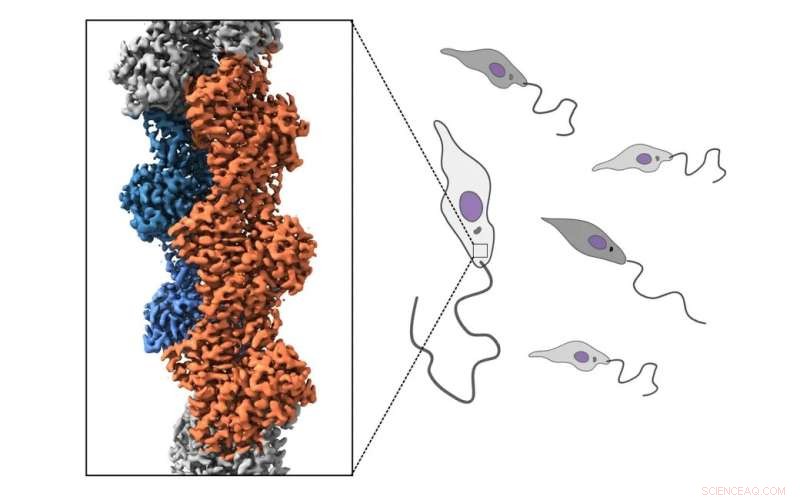
Los parásitos de Leishmania tienen un citoesqueleto de actina, que es una red compleja y dinámica de filamentos compuestos por una proteína llamada actina. En los seres humanos, el citoesqueleto de actina interviene en muchos de los procesos de las células, como la migración, la morfogénesis y la absorción de nutrientes. En los parásitos de Leishmania, el citoesqueleto de actina parece impulsar únicamente la absorción de nutrientes. Tanto la propia actina de Leishmania como las proteínas que regulan el citoesqueleto de actina del parásito son muy diferentes a las de los humanos.
Un nuevo estudio llevado a cabo en la Universidad de Helsinki, Finlandia y en la Université Paris Cité, CNRS, Institut Jacques Monod, Francia, reveló cómo se regula el citoesqueleto de actina en el parásito principal Leishmania. Según el estudio, los filamentos de actina de este parásito evolutivamente distante son mucho más dinámicos en comparación con los filamentos de actina de las células humanas. A través de la determinación de las estructuras atómicas de los filamentos de actina del parásito, el estudio también revela la base molecular de la renovación notablemente rápida de los filamentos de actina de Leishmania.
Al centrarse en la actina más divergente estudiada hasta el momento, este trabajo arroja luz sobre los orígenes evolutivos del citoesqueleto de actina.
"Nuestro estudio sugiere que los filamentos de actina de los eucariotas antiguos eran muy dinámicos. A lo largo de la evolución, el citoesqueleto de actina se volvió más complejo y más involucrado en un mayor número de funciones celulares. Proponemos que esto estuvo acompañado por la estabilización de los filamentos de actina y la simultánea aparición de una amplia gama de proteínas, que aceleran y controlan la dinámica de los filamentos de actina", dice el autor principal del estudio, Tommi Kotila, de la Universidad de Helsinki.
Las diferencias estructurales entre el parásito Leishmania y las actinas humanas también pueden aprovecharse para generar inhibidores específicos contra las actinas del parásito.
"Los fármacos contra la leishmaniasis actualmente disponibles tienen problemas de toxicidad y los parásitos han desarrollado formas de lograr la resistencia a los fármacos. Por lo tanto, necesitamos fármacos nuevos y más específicos para tratar la leishmaniasis, y los compuestos contra la actina podrían ser buenos candidatos", dice el profesor de la Academia Pekka Lappalainen de la Universidad de Helsinki.
La investigación se publica en Nature Communications . Resuelto el misterio de la motilidad celular:revelada la proteína que recarga la maquinaria de motilidad celular