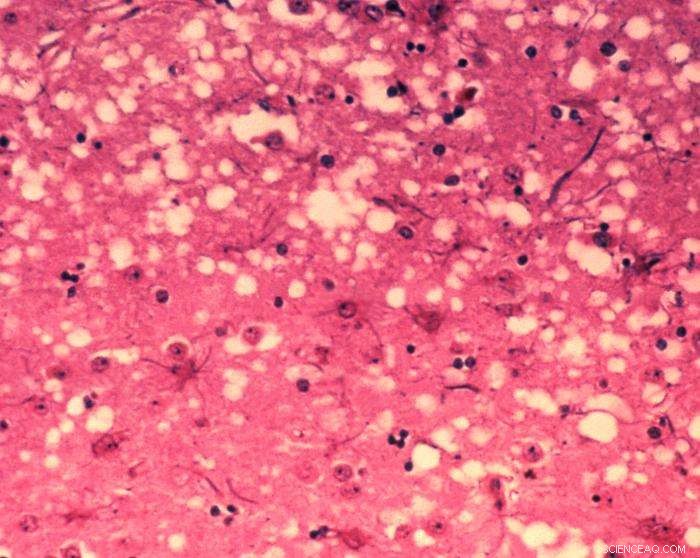
Esta micrografía de tejido cerebral revela los cambios histopatológicos citoarquitectónicos que se encuentran en la encefalopatía espongiforme bovina. La presencia de vacuolas, es decir, "agujeros" microscópicos en la materia gris, le da al cerebro de las vacas afectadas por BSE una apariencia de esponja cuando se examinan las secciones de tejido en el laboratorio. Crédito:Dr. Al Jenny - Biblioteca de imágenes de salud pública, APHIS:Dominio público
En un nuevo estudio, investigadores de la Facultad de Medicina de la Universidad Case Western Reserve han identificado la estructura de las fibrillas de proteína vinculadas a una forma hereditaria de enfermedad priónica humana. Esta idea, dicen, revela el mecanismo por el cual los priones pueden saltar entre algunas especies animales, mientras retienen una barrera de transmisibilidad entre otras especies.
Si bien sus hallazgos no tienen implicaciones inmediatas para el desarrollo de nuevas terapias para los trastornos priónicos humanos más comunes, como la enfermedad de Creutzfeldt-Jakob, el trabajo sugiere que el potencial de transmisión de la enfermedad de una especie a otra se puede predecir en función de la información estructural.
"Una de las principales preguntas pendientes en el campo de las enfermedades priónicas ha sido por qué estas enfermedades son transmisibles entre algunas especies animales pero no entre otras", dijo Witold Surewicz, profesor del Departamento de Fisiología y Biofísica de la Facultad de Medicina y autor del estudio. autor principal. "Nuestros hallazgos explican cómo funciona esto".
El estudio fue publicado en Nature Structural &Molecular Biology . Qiuye Li, becario postdoctoral en la Facultad de Medicina, fue el autor principal. El estudio fue coautor de Christopher Jaronec, profesor de química y bioquímica en la Universidad Estatal de Ohio.
Las enfermedades priónicas, también conocidas como "encefalopatías espongiformes transmisibles", son un grupo de trastornos infecciosos de desgaste cerebral que incluyen, entre otros, la enfermedad de Creuzfeldt-Jakob en humanos, la encefalopatía espongiforme bovina (enfermedad de las vacas locas) en el ganado y la enfermedad crónica del desgaste en los ciervos. y alce.
Estos trastornos mortales son únicos debido a su patógeno infeccioso, que no es un virus sino una forma anormal de la proteína priónica.
Esta proteína deformada se ensambla en fibrillas largas que se propagan actuando como una plantilla, o "semilla", que se une a la proteína priónica normal y la obliga a cambiar de forma a una forma anormal que causa enfermedades, dijo Surewicz.
Si bien las proteínas con formas anormales pueden actuar fácilmente como moldes para convertir las proteínas priónicas normales de la misma especie, se cree que la siembra cruzada está restringida debido a las diferencias que dependen de la especie en la secuencia de aminoácidos, los componentes básicos de cada proteína.
"Parece que las barreras, o la falta de ellas, están totalmente dictadas por la capacidad de la proteína priónica de una especie para adoptar la estructura de las semillas de fibrillas priónicas de otra especie", dijo Li. "Esto, a su vez, depende de las diferencias en los aminoácidos en las posiciones clave que determinan la estructura".
Anteriormente, los científicos del laboratorio de Surewicz desarrollaron un modelo que empleaba una forma truncada de proteínas priónicas que les permitía estudiar en el tubo de ensayo los mecanismos de propagación priónica, incluido el fenómeno de las barreras de transmisibilidad (siembra).
Sin embargo, la comprensión completa de estos mecanismos se vio obstaculizada por la falta de información sobre la estructura de las fibrillas infecciosas formadas por estas proteínas.
Los autores superaron esta limitación fundamental mediante el uso de una técnica de microscopía crioelectrónica, un tipo de microscopía en la que las imágenes se recopilan a muy baja temperatura.
Al analizar en la computadora miles de imágenes de fibrillas formadas por proteínas priónicas de modelo humano y de ratón, determinaron la arquitectura de estas fibrillas con una resolución cercana a los átomos individuales. Este conocimiento estructural permitió a los investigadores explicar, en términos estructurales precisos, por qué existen barreras de transmisibilidad de priones entre algunas especies mientras que tales barreras no se observan entre otras especies.
"Aunque nuestros estudios actuales se realizaron utilizando un sistema modelo", dijo Surewicz, "la capacidad de racionalizar y predecir las barreras de transmisibilidad de priones en función de los datos estructurales tiene implicaciones prácticas importantes, especialmente dada la epidemia actual de enfermedad crónica entre los alces y los ciervos en partes de los Estados Unidos y Canadá, y las crecientes preocupaciones sobre la posible transmisión de esta enfermedad a los humanos". Proteínas corruptas en el punto de mira:cómo la forma da lugar a variaciones de enfermedades cerebrales mortales