Crédito:Samar A. Mahmoud et al, Informes de celda (2022). DOI:10.1016/j.celrep.2022.111405
En una nueva investigación publicada recientemente en la revista Cell Reports , un equipo de científicos de la Universidad de Massachusetts Amherst profundizó en los misterios de cómo las células resisten el estrés. Usando células bacterianas, los investigadores descubrieron que una enzima reparadora de daños, llamada ClpX, no solo puede mutar para solucionar múltiples problemas celulares, sino que también puede responder a los niveles cambiantes de energía celular para ayudar a mantener una célula sana.
"Lo que realmente nos interesa", dice Peter Chien, profesor de bioquímica y biología molecular en UMass Amherst y autor principal del artículo, "es cómo responden las células al estrés. Estudiamos una clase de enzimas, llamadas proteasas, que se dirigen y destruir las proteínas dañinas dentro de una célula. Estas proteasas pueden reconocer selectivamente proteínas individuales específicas, proteínas singulares. Pero, ¿cómo hacen esto? ¿Cómo pueden elegir entre proteínas saludables y dañinas?"
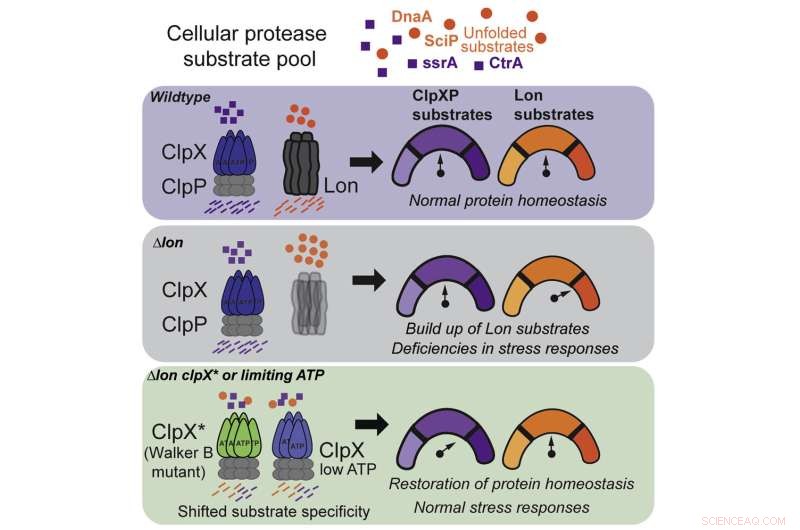
Para responder a esta pregunta, Chien y sus coautores se centraron en dos proteasas específicas, conocidas como Lon y ClpX, cada una de las cuales está exquisitamente sintonizada para reconocer una proteína dañina diferente. Durante mucho tiempo se pensó que Lon y ClpX funcionaban como llaves:cada uno podía abrir solo una cerradura específica y ninguna otra, y si una celda carecía de cualquiera de las dos, se producirían efectos secundarios graves.
"Si alguna vez ha tenido un compañero de cuarto universitario extremadamente desordenado", dice Chien, "sabe lo importante que es vaciar la basura con regularidad. Extrañar la proteasa Lon es como tener un compañero de cuarto que nunca se lava, cambia o limpia".
Pero, después de una serie de experimentos que involucraron la eliminación de Lon de colonias de células bacterianas, el equipo de Chien comenzó a notar algo extraño:algunas de las colonias estaban sobreviviendo.
Esta observación condujo a su primer descubrimiento:ClpX puede mutar para realizar una función similar a la de Lon, aunque pierde algunas de sus habilidades de ClpX. Es como si para mantener limpio tu dormitorio, comenzaras a lavar los calcetines de tu compañero de cuarto, pero tuvieras que sacrificar parte de tu propia ropa limpia para hacerlo.
Al rastrear exactamente cómo la mutación ClpX permitió que la proteasa expandiera su función, el equipo hizo su segundo descubrimiento:ClpX salvaje, no mutante, también puede realizar algunas de las funciones de Lon, en las condiciones adecuadas.
Resulta que ClpX es muy sensible al ATP, un compuesto orgánico que es la fuente de energía de todas las células vivas. En niveles normales de ATP, ClpX se enfoca en sus propias funciones, pero en un umbral más bajo específico, de repente comienza a limpiar después de Lon.
"Este es un verdadero avance en la comprensión básica de cómo funcionan las células", dice Chien. "Cambia las reglas:la energía celular no solo controla qué tan rápido funciona una célula, sino también cómo funciona". El complejo proteico ClpX-ClpP podría ser el punto de partida para nuevos antibióticos