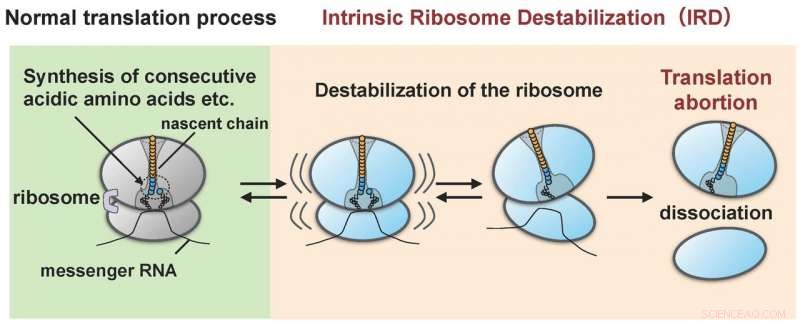
El ribosoma se desestabiliza por la proteína (cadena naciente) que ella misma sintetizó (IRD) y se divide en subunidades grandes y pequeñas. Como resultado, la síntesis de proteínas finaliza a mitad del ciclo sin llegar al punto final. Crédito:Hidekii Taguchi
Un grupo de investigación conjunto del Instituto de Tecnología de Tokio (Tokyo Tech) y la Universidad Sangyo de Kioto ha descubierto que una proteína, durante su síntesis, puede desestabilizar la estructura del ribosoma y terminar su propia síntesis prematuramente, y encontró que este fenómeno se utiliza para adaptar la célula a su entorno.
Fondo
Las proteínas son moléculas funcionales, que sostienen la vida y son estructuras tridimensionales de cadenas polipeptídicas, cadenas de aminoácidos enlazados. La configuración de los aminoácidos en esta cadena (la secuencia) está escrita en la secuencia de ADN. Las cadenas polipeptídicas se forman donde el ribosoma, la maquinaria de síntesis de proteínas, reside en una copia de la secuencia de ADN (ARN mensajero). Comienza a polimerizar los aminoácidos uno por uno seleccionando entre 20 tipos de aminoácidos para agregar al enlace de acuerdo con el código genético. Se completa en el punto final donde la cadena se desprende del ribosoma.
El proceso de síntesis de una proteína en un ribosoma se denomina "traducción, "y todas las proteínas de todos los organismos vivos, incluidos los humanos, se producen a través de la traducción. Se había pensado que, en el proceso de unir aminoácidos en el ribosoma, la cadena polipeptídica recién formada (cadena naciente) se sintetizó continuamente.
En estudios recientes de este grupo de investigación y otros, se ha hecho evidente que la fluctuación en la velocidad ocurre significativamente en la traducción, que algunas cadenas nacientes, dependiendo de la secuencia de aminoácidos, actuar sobre el ribosoma que lo está formando para ralentizar el tiempo de transición de la traducción.
Resumen del logro de la investigación
El grupo de investigación dirigido por Hideki Taguchi en Tokyo Tech y Koreaki Ito en la Universidad Sangyo de Kyoto encontró que, cuando un sistema de traducción libre de células reconstituido de E. coli se hizo para traducir proteínas que tienen secuencias de aproximadamente diez aminoácidos ácidos (ácidos aspártico y glutámico) o secuencias en las que un aminoácido ácido y un aminoácido llamado prolina están enlazados alternativamente, la traducción se detiene a mitad de camino cuando dicha secuencia ha sido traducida. Este evento abortivo ocurre cuando los ribosomas que sintetizan la secuencia de aminoácidos se desestabilizan como resultado de la acción de la cadena naciente (los investigadores lo denominan "IRD":"desestabilización intrínseca del ribosoma"). Da como resultado que el ribosoma se divida en subunidades grandes y pequeñas (Figura 1). El ribosoma con su función de sintetizar varios miles o decenas de miles de tipos de proteínas dentro de la célula, Se pensaba que estaba al mando de unir cualquier combinación de secuencias de aminoácidos. Sin embargo, el descubrimiento de IRD, en el que el ribosoma se desestabiliza durante la traducción por cadenas nacientes que él mismo está sintetizando, indica que la traducción es algo que progresa con el riesgo potencial de ser abortado. Las proteínas que incluyen secuencias de aminoácidos que desencadenan la IRD no pueden completar su síntesis.
A primera vista, este fenómeno de IRD puede parecer un defecto del ribosoma, pero ¿qué indica para los organismos vivos?
Los investigadores habían descubierto que los organismos vivos también poseen un mecanismo para contrarrestar el IRD. Este hallazgo los llevó a utilizar un mutante de E. coli al que le faltaba este mecanismo, con ribosomas así ligeramente desestabilizados y propensos a IRD, y analizar toda la proteína dentro de una célula (el proteoma). Como resultado, el equipo descubrió que, en el mutante, las cantidades celulares de varias proteínas variaron en comparación con la cepa salvaje. En particular, MgtA, una proteína de membrana que transporta iones de magnesio a las células, se encontró que se expresa diez veces más. Curiosamente, el gen llamado mgtL y que regula la expresión de MgtA poseía una secuencia IRD. El resultado del análisis mostró que E. coli regula la expresión de MgtA, utilizando un mecanismo especial que presenta el fenómeno IRD debido a la secuencia de mgtL, en respuesta a cambios en las concentraciones de magnesio en la célula.
Los iones de magnesio son necesarios para muchos procesos de la vida dentro de la célula, y es necesario para la traducción, en particular, para estabilizar el ribosoma. Por lo tanto, Los hallazgos de esta investigación sugieren que E. coli adquirió un mecanismo para mantener la concentración de iones de magnesio celular mediante el uso de la capacidad IRD de mgtL para expresar una abundancia de MgtA cuando su entorno de crecimiento se vuelve pobre en magnesio. En otras palabras, un organismo vivo tiene un mecanismo para monitorear cambios en el ambiente intracelular aprovechando el fenómeno de IRD (Figura 2).
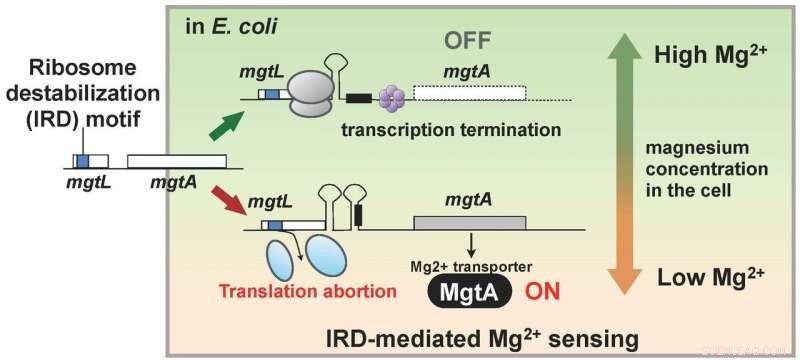
El gen mgtL, controlar la expresión de la proteína de membrana MgtA que transporta magnesio al interior de las células tiene una secuencia desestabilizadora de los ribosomas, y la traducción se interrumpe cuando la concentración de magnesio dentro de la célula es baja. Existe un mecanismo que activa la síntesis de MgtA cuando se interrumpe la traducción de mgtL, y se cree que la abundante expresión resultante de MgtA aumenta la concentración de iones de magnesio dentro de la célula. Crédito:Hideki Taguchi
Futuros desarrollos
Este estudio reveló que, además de contener información que determina estructuras tridimensionales de proteínas, Las secuencias de aminoácidos incluso tienen la capacidad de influir en la estabilidad de la maquinaria que las sintetiza y de abortar la traducción a mitad del ciclo. finalmente. Esto fomenta nuestra comprensión de la base de los procesos de la vida, que están respaldados por la expresión regulada de información genética. Temprano, Hasta la fecha, el cese prematuro de la traducción no se ha considerado un proceso vital en las ciencias de la vida. Taguchi y los miembros del equipo creen que su logro puede expandirse, en conjunción con la prosperidad actual de las ciencias de la vida, a diversas aplicaciones como la producción de nuevas proteínas útiles o el desarrollo de biofarmacéuticos.