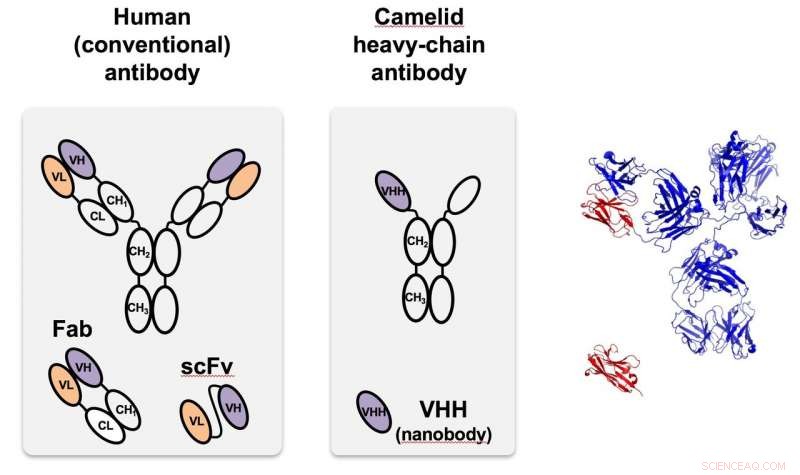
El nanocuerpo de camélidos (centro), identificado por primera vez en camellos, es un anticuerpo de cadena pesada que es mucho más pequeño y más fácil de programar que los anticuerpos que se encuentran en la mayoría de los organismos, incluidos los humanos, así a la izquierda. A la derecha, el camélido monomérico (rojo) se compara con la estructura del anticuerpo humano de tamaño completo. VHH es un nanocuerpo diseñado para atacar proteínas fluorescentes verdes utilizadas en pruebas de prueba de principio en Rice. Crédito:Grupo de Investigación Segatori / Universidad Rice
Un anticuerpo a nanoescala que se encontró por primera vez en camellos combinado con una molécula que degrada las proteínas es una nueva plataforma eficaz para controlar los niveles de proteínas en las células. según los científicos de la Universidad de Rice. La técnica podría ayudar a la investigación fundamental de la dinámica celular, así como al diseño de circuitos de genes sintéticos.
La ingeniera química y biomolecular de Rice Laura Segatori, El ex estudiante de posgrado Wenting Zhao y el ex estudiante de pregrado Lara Pferdehirt inventaron un sistema de reconocimiento bifuncional al que llaman NanoDeg. Les permite apuntar a proteínas específicas en una célula y regular estrictamente su degradación.
El sistema plug-and-play permitirá a los biólogos sintéticos estudiar la función de una proteína específica dentro del entorno celular al evaluar cómo el nivel de expresión de la proteína afecta la vida de una célula. Dijo Segatori.
La investigación aparece en la revista American Chemical Society Biología sintética ACS .
NanoDeg acelera la proteólisis, la degradación enzimática de las proteínas, para controlar los niveles de proteínas objetivo después de la traducción.
Una función surge del anticuerpo monocatenario de los camélidos, que se puede personalizar para apuntar a proteínas específicas. Cuando se descubrieron los anticuerpos en camellos (y más tarde en tiburones), los investigadores reconocieron rápidamente sus propiedades únicas, incluyendo su pequeño tamaño, alta solubilidad y capacidad para reconocer incluso objetivos que están ocultos o en estados intermedios. Son mucho más pequeños que los anticuerpos que se encuentran naturalmente en los seres humanos y la mayoría de los demás organismos, pero pueden fabricarse y modificarse fácilmente en bacterias y otras células.
La otra función se basa en grados, secuencias cortas en proteínas que son responsables de regular la velocidad de degradación de una proteína. Estos también se pueden personalizar para ajustar el agotamiento de una proteína objetivo a los niveles deseados.
Cuando se combina como NanoDegs, se vuelven poderosos, plataforma universal para modular los niveles de proteínas celulares, Dijo Segatori.
"Esencialmente, nos permite controlar la cantidad específica de proteínas en las células, ", dijo." Podemos adaptarlo para apuntar a cualquier proteína en una célula, y una vez que el nanocuerpo etiquetado con degron se une a ese socio, todo el complejo se degrada.
"La ventaja de este sistema es que se dirige a la expresión a nivel de proteínas, "Dijo Segatori." Normalmente, cuando la gente quiere modular la cantidad de proteínas en las células, actúan a nivel del ADN o del ARN —el genético—. Pero al actuar a nivel de proteínas, podemos apuntar a diferentes modificaciones posteriores a la regulación, y mucho más importante, tenemos mucho más control sobre la velocidad y el grado de agotamiento de la proteína ".
Como prueba de principio, Los investigadores diseñaron un circuito genético sintético que expresaba tanto proteína fluorescente verde (GFP), que los investigadores utilizan para informar sobre los procesos celulares, y un NanoDeg que lo apunta. "Usamos GFP porque es un indicador de uso común y la fluorescencia es fácil de medir, ", Dijo Segatori." Cuando el nanocuerpo reconoce GFP, todo el complejo se toma por degradación ".
También será útil para quienes deseen información más limpia sobre las actividades de las proteínas en las células.
"Supongamos que diseña un circuito genético en el que la expresión de GFP se activa cuando la célula está bajo estrés, como la inanición de nutrientes o el calor, por ejemplo, ", Dijo Segatori." Cuando la célula está expuesta al estímulo, Se expresa GFP y puede detectar un aumento en la fluorescencia celular.
"Pero cuando quitas el estímulo, la caída de la señal no refleja necesariamente la caída del estímulo; refleja la estabilidad del reportero de GFP, ", dijo." Lo que hemos hecho es crear un circuito genético en el que la expresión de GFP se activa bajo estímulo, pero cuando el estímulo se apaga, el NanoDeg degrada GFP muy rápidamente. Eso aumenta la sensibilidad y la resolución dinámica de un circuito genético sintético ".