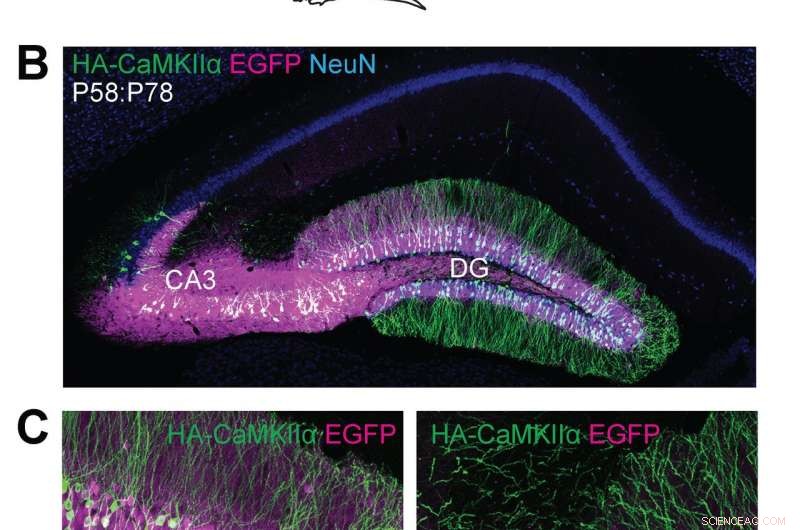
(A) Ilustraciones esquemáticas de experimentos. (B, C) Imágenes microscópicas confocales de secciones cerebrales coronales del hipocampo de ratones Cas9, mostrando la fluorescencia de EGFP (B, C, magenta), inmunorreactividades para NeuN (B, azul) y la etiqueta HA (B, C, verde) fusionado al extremo N de la CaMKIIα endógena. Crédito:Instituto Max Planck de Florida para Neurociencias
Las tecnologías de edición del genoma han revolucionado la ciencia biomédica, proporcionando una forma rápida y fácil de modificar genes. Sin embargo, la técnica que permite a los científicos realizar las ediciones más precisas, no funciona en células que ya no se están dividiendo, lo que incluye la mayoría de las neuronas del cerebro. Esta tecnología tenía un uso limitado en la investigación del cerebro, hasta ahora. Investigador Jun Nishiyama, MARYLAND., Doctor., Investigador científico, Takayasu Mikuni, MARYLAND., Doctor., y Director Científico, Ryohei Yasuda, Doctor. en el Instituto Max Planck de Florida para Neurociencias (MPFI) han desarrollado una nueva herramienta que, por primera vez, permite la edición precisa del genoma en neuronas maduras, abriendo vastas nuevas posibilidades en la investigación de las neurociencias.
Esta novedosa y poderosa herramienta utiliza la tecnología de edición de genes recientemente descubierta de CRISPR-Cas9, un mecanismo de defensa viral que se encuentra originalmente en las bacterias. Cuando se coloca dentro de una célula, como una neurona, el sistema CRISPR-Cas9 actúa para dañar el ADN en un lugar específico. Posteriormente, la celda repara este daño utilizando principalmente dos métodos opuestos; uno es unión final no homóloga (NHEJ), que tiende a ser propenso a errores, y reparación dirigida por homología (HDR), que es muy precisa y capaz de sufrir inserciones genéticas específicas. HDR es el método más deseado, permitiendo a los investigadores flexibilidad para agregar, modificar, o eliminar genes según el propósito previsto.
Convencer a las células del cerebro para que utilicen preferentemente el mecanismo de reparación del ADN HDR ha sido un desafío. Originalmente, se pensó que la HDR solo estaba disponible como una ruta de reparación para las células que proliferan activamente en el cuerpo. Cuando las células precursoras del cerebro maduran y se convierten en neuronas, se les conoce como células posmitóticas o no en división, haciendo que el cerebro maduro sea en gran medida inaccesible para HDR, o eso pensaban los investigadores. El equipo ahora ha demostrado que es posible que las neuronas posmitóticas del cerebro se sometan activamente a HDR, denominada la estrategia "vSLENDR (marcaje unicelular mediado por virus de proteínas endógenas mediante reparación dirigida por homología mediada por CRISPR-Cas9)". La clave fundamental para el éxito de este proceso es el uso combinado de CRISPR-Cas9 y un virus.
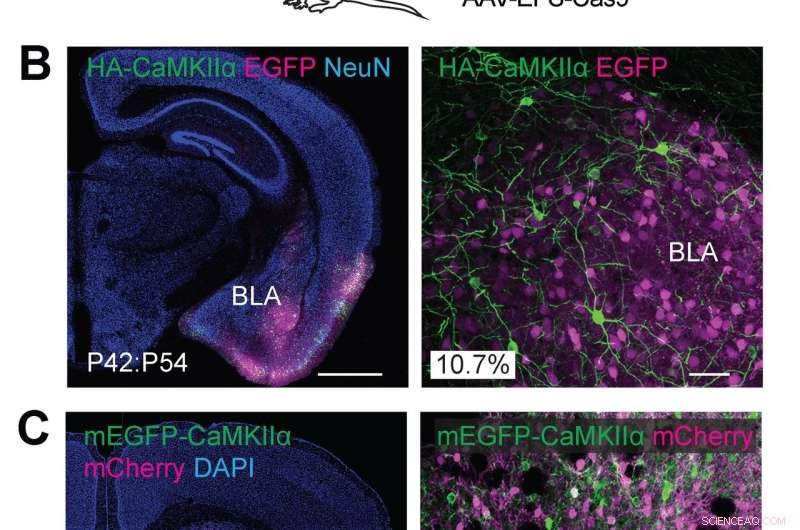
(A) Ilustraciones esquemáticas de experimentos. (B) Imágenes microscópicas confocales de secciones cerebrales coronales de la amígdala de ratones de tipo salvaje, mostrando la fluorescencia de EGFP (B, magenta), inmunorreactividades para NeuN (izquierda) y la etiqueta HA (verde) fusionada al extremo N de la CaMKIIα endógena. (C) Imágenes microscópicas confocales de secciones cerebrales coronales del cuerpo estriado de ratones de tipo salvaje, mostrando la señal DAPI (izquierda), la fluorescencia mCherry (magenta), la fluorescencia de mEGFP (verde) fusionada al extremo N-terminal de la CaMKIIα endógena. Crédito:Instituto Max Planck de Florida para Neurociencias
El virus adenoasociado (AAV) es un inmunogénico bajo, virus no tóxico utilizado por los científicos como un mecanismo de administración eficiente para todo tipo de genes. Este virus puede proporcionar efectivamente la plantilla de donante necesaria para HDR, aumentando su eficiencia. El equipo primero empaquetó la maquinaria necesaria para la edición del genoma en el AAV y la entregó a las neuronas de ratones transgénicos que expresan Cas9. logrando HDR espectacularmente eficiente en neuronas posmitóticas del cerebro.
A continuación, crearon un sistema de doble viral que les permitía utilizar la tecnología en animales que no habían sido diseñados para expresar Cas9. Probaron este sistema dual viral en un modelo de ratón envejecido con enfermedad de Alzheimer y demostraron que la técnica vSLENDR puede ser aplicable en modelos patológicos incluso en edades avanzadas.
vSLENDR es una nueva y poderosa herramienta tanto para las ciencias básicas como para las traslacionales, capaz de la edición precisa de información genética independientemente del tipo de célula, madurez celular, región del cerebro, o edad. El nuevo vSLENDR es más eficiente, flexible, y conciso, permitiendo a los investigadores el potencial de estudiar una gran variedad de procesos y funcionalidades cerebrales con una facilidad sin precedentes. Igualmente importante es su uso potencial en modelos de enfermedades neuropatológicas, acelerar la investigación y el desarrollo de nuevas terapias; establecer la ciencia básica de hoy como base para las curas del mañana.
El estudio se publica en Neurona .