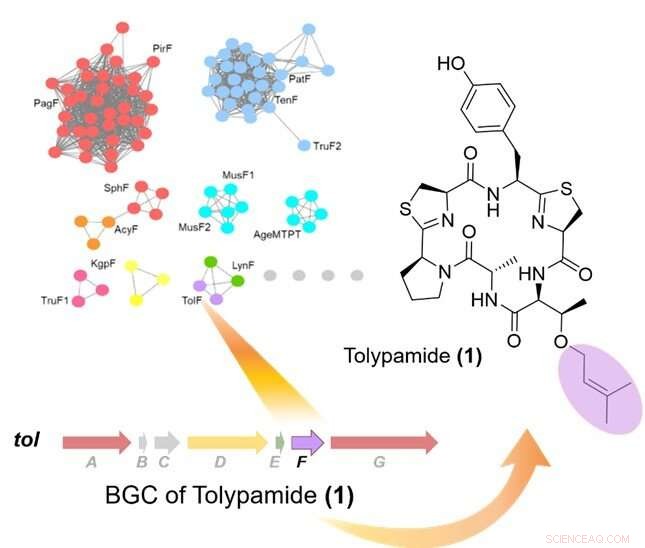
Figura 1:La extracción del genoma dirigida de preniltransferasas identificó la enzima TolF y la tol grupo de genes biosintéticos (BGC). La parte superior izquierda muestra una red de similitud de secuencias de proteínas de preniltransferasas. El grupo de genes biosintéticos para el tol se muestra la vía y se vinculó a la biosíntesis de tolipamida. La tolipamida contiene un residuo de treonina prenilada hacia adelante (de color púrpura). Crédito:Universidad Nacional de Singapur
Los investigadores de NUS utilizaron un enfoque de minería del genoma para identificar un nuevo péptido cíclico (tolipamida) derivado de una cianobacteria. La biosíntesis de tolipamida presenta un nuevo tipo de enzima que es capaz de prenilar una variedad de sustratos y tiene un uso potencial en química farmacéutica y biología sintética.
Los péptidos bioactivos se han afianzado en el mercado farmacéutico debido a las numerosas ventajas, como la focalización eficaz de las interacciones proteína-proteína, bajos efectos fuera del objetivo, y baja toxicidad. Estas ventajas a menudo se ven comprometidas debido a la escasa biodisponibilidad y permeabilidad celular. Una forma de mejorar la permeabilidad de la membrana es aumentar la lipofilicidad añadiendo una cadena de alquilo a la molécula (prenilación). Estas transformaciones, que puede ser catalizada por enzimas involucradas en la biosíntesis de productos naturales de cianobactina, potencialmente puede aumentar la eficacia terapéutica de péptidos no modificados. También, Las enzimas cianobactinas tienen una amplia selectividad de sustrato y actúan de una manera muy selectiva y específica con respecto a la posición y orientación de los residuos de aminoácidos. Comprender la razón fundamental detrás de la selectividad y especificidad de estos catalizadores ayudará a aprovechar la capacidad de estas enzimas como kits de herramientas bioquímicas.
En colaboración con un equipo de investigación internacional, Prof Brandon Morinaka del Departamento de Farmacia, La Universidad Nacional de Singapur descubrió un nuevo tipo de enzima cianobactina conocida como ToIF. Presenta selectividad específica para la modificación de residuos de serina y treonina en péptidos. Este trabajo es un esfuerzo de investigación conjunto con el profesor Eric Schmidt de la Universidad de Utah y la Dra. Muriel Gugger del Institut Pasteur. Las proteínas de una subfamilia de preniltransferasas se mapearon en una red de similitud de secuencia.
Los investigadores aplicaron la minería del genoma dirigida para analizar los grupos de genes que codifican estas proteínas e identificaron la enzima ToIF y la vía biosintética de tol. Descubrieron que la enzima TolF participa en la producción de tolipamida, que tiene un grupo funcional prenilo hidrófobo unido a su estructura (Figura 1). Tales uniones moleculares son útiles para mejorar la permeabilidad de la membrana de los compuestos terapéuticos. La enzima TolF fue validada funcionalmente por biosíntesis in vitro del producto natural de tolipamida (Figura 2). Los ensayos bioquímicos adicionales muestran que la enzima TolF también es capaz de facilitar la prenilación directa en los residuos de treonina y serina en varios péptidos sintéticos.
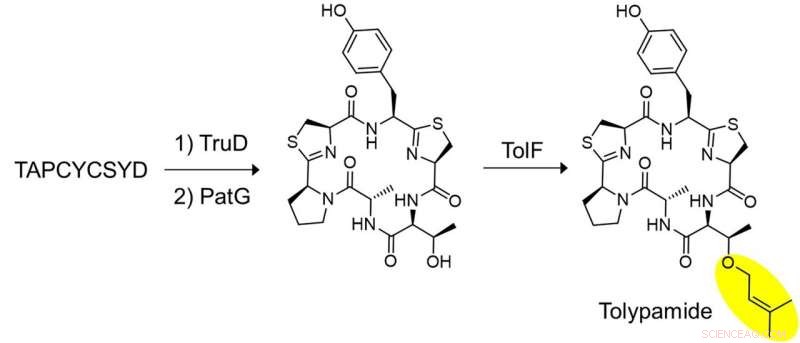
Figura 2:Biosíntesis in vitro de tolipamida y validación funcional de TolF. Se llevó a cabo un conjunto clave de experimentos para demostrar que TolF actúa sobre el péptido cíclico heterociclizado. El péptido sintetizado, TAPCYCSYD se incubó secuencialmente con las enzimas, TruD (heterociclasa) y PatG (macrociclasa) para proporcionar el péptido cíclico heterociclizado. La incubación con TolF dio una conversión cuantitativa al producto natural tolipamida. Crédito:Universidad Nacional de Singapur
Hasta la fecha, el único otro miembro de esta clase de enzimas (preniltransferasa) identificado para actuar sobre los residuos de serina o treonina es TruF1. Sin embargo, su escasa solubilidad y baja actividad in vitro ha impedido una caracterización extensa. El descubrimiento de TolF brinda la oportunidad de estudiar la biología estructural y la evolución de esta familia de enzimas.
El profesor Morinaka dijo:"Una mayor caracterización de la enzima TolF permitirá una comprensión más completa de la especificidad del sustrato y la selectividad de las preniltransferasas. Esto facilitará la ingeniería racional de estos biocatalizadores como herramientas poderosas en el campo de la biología sintética".