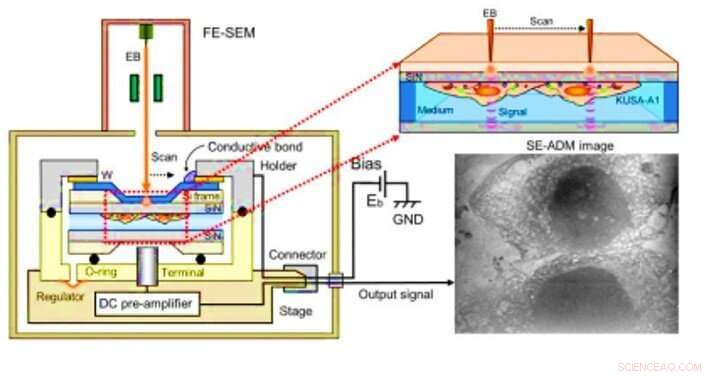
Observación de osteoblastos con microscopía dieléctrica asistida por electrones (SE-ADM). (A) SE-ADM de alta resolución configurado para la observación de osteoblastos. El soporte para muestras líquidas, incluidos los osteoblastos, está montado en la platina acoplada al preamplificador, que se introduce en la cámara SEM de muestras. El haz de electrones de barrido se aplica a la película de SiN recubierta con W a un voltaje de aceleración bajo. El terminal de medición debajo del soporte detecta señales eléctricas a través de muestras líquidas. Se ven estructuras intracelulares claras (imagen de la derecha). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
La mineralización está mediada por osteoblastos, que segregan precursores minerales a través de vesículas de matriz (MV) como proceso fundamental en los vertebrados. Las vesículas son ricas en calcio y fosfato, que contiene materiales orgánicos como proteínas ácidas. En un nuevo estudio ahora publicado en Avances de la ciencia , Tomoaki Iwayama y colegas de los departamentos de periodoncia, investigación biomédica, ciencia oral, El desarrollo de biomateriales y anatomía oral utilizó microscopía dieléctrica asistida por electrones de barrido (SE-ADM) y microscopía de superresolución (SRM) para evaluar los osteoblastos vivos durante las condiciones de mineralización a una resolución de nano nivel. Descubrieron que las vesículas que contienen calcio son cuerpos multivelesiculares que contienen nanovesículas mineralizantes o vesículas de matriz (MV). Según las observaciones, las MV podrían transportarse junto con los lisosomas y secretarse por exocitosis. Iwayama y col. presentó pruebas de que los lisosomas podían transportar fosfato de calcio amorfo en las células de osteoblastos mineralizantes.
Durante el proceso fisiológico de mineralización ósea, el depósito de cristales de fosfato cálcico se produce en la matriz extracelular como un proceso fundamental en todos los vertebrados. En 1967, los biólogos Clarke Anderson y Ermanno Bonucci, partículas relacionadas con minerales visualizadas individualmente en el espacio extracelular mediante microscopía electrónica (EM). Posteriormente, los científicos reconocieron estas partículas como nano-vesículas mineralizantes o vesículas de matriz (MV). Durante los últimos 50 años de estudios EM sobre VM, Los biólogos se han esforzado por comprender el mecanismo de formación y secreción de VM, que sigue siendo en gran parte desconocido.
Aclarar el proceso de mineralización de células vivas con EM es un desafío ya que la preparación de muestras para EM requiere pasos tanto en la fijación química como en la deshidratación alcohólica. Los pasos pueden inducir artefactos e incluso disolver o eliminar precursores minerales inestables dejando un andamio orgánico conocido como "fantasma de cristal". Si bien los científicos habían utilizado con éxito el proceso de EM utilizando tejido fijo y deshidratado para ver la estructura de las fibrillas de colágeno mineralizado en el hueso, estudiar precursores minerales, deben emplear procesos crio-EM para evitar la deshidratación y facilitar costosos, Enfriamiento extremadamente rápido con muestras pequeñas.
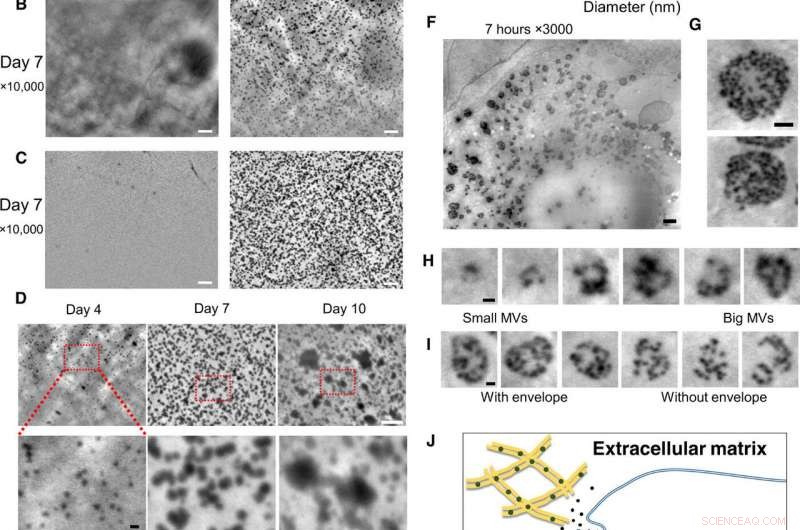
Observación a nanoescala de osteoblastos vivos en medios de cultivo, utilizando el sistema SE-ADM. (A) Imágenes SE-ADM de alta resolución representativas de osteoblastos cultivados con o sin medio osteogénico durante 2 días. Las partículas negras fueron evidentes solo cuando se cultivaron en medios osteogénicos (derecha, cuadrado en la parte inferior). (B) Imágenes SE-ADM de alta resolución representativas de osteoblastos cultivados con o sin medio osteogénico durante 7 días. Hay muchas partículas negras cuando se cultivan en medios osteogénicos (derecha). (C) Imágenes SE-ADM de alta resolución representativas de la película de SiN después de la eliminación de células. En medios normales, no se observan partículas (izquierda). La imagen de la película después de la eliminación de las células cultivadas en medio osteogénico muestra muchas partículas negras claras dispersas en toda el área (derecha). (D) Comparación de imágenes de partículas durante 4 a 10 días de cultivo en medio osteogénico. Los tamaños de partículas aumentaron gradualmente. (E) Distribución del tamaño de partícula medido durante 4 a 10 días de cultivo en medio osteogénico. Se midieron aproximadamente de 900 a 1100 partículas por punto de tiempo y se trazaron como un histograma. (F) Imágenes SE-ADM de alta resolución representativas de osteoblastos cultivados con medios osteogénicos durante 7 horas. (G) Los MVB tienen sobres de color gris claro. (H) Cortar imágenes de varios tamaños de MVB, incluyendo partículas. (I) Comparación de MVB con o sin sobre gris. (J) Vista esquemática de la formación intracelular y el transporte de MVB en la mineralización de osteoblastos. Barras de escala, 1 μm en (A) a (C) y (F); 500 nm en (G); 200 nm en (D, fondo), (H), y yo). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
Para superar estas limitaciones en el presente trabajo, Iwayama y col. utilizó un nuevo sistema microscópico conocido como microscopía dieléctrica asistida por electrones de barrido (SE-ADM). El método había logrado previamente una resolución a nanoescala e imágenes de alto contraste para células de mamíferos en medios acuosos sin tinción. Los científicos utilizaron la misma técnica (SE-ADM de alta resolución) para explorar la posibilidad de ver MV en osteoblastos intactos para comprender la biogénesis del tráfico de MV. Para la línea celular de osteoblastos utilizaron la línea celular osteoblástica murina (ratón) KUSA-A1, con alta capacidad osteogénica in vitro e in vivo. Después del cultivo celular en condiciones adecuadas, Iwayama y col. observó las células con SE-ADM para identificar estructuras intracelulares normales. Los científicos observaron que las MV se alineaban con las fibrillas de colágeno después de 4 a 10 días de crecimiento celular en medios osteogénicos y que el tamaño de las partículas secretadas aumentaba debido a la fusión o al crecimiento de las partículas. con sus tamaños consistentes con informes anteriores para sugerir que efectivamente eran MV.
Tras un examen más detenido con SE-ADM, observaron la participación de la vía lisosomal para transportar y secretar VM intraluminales en un proceso similar a los exosomas. Curiosamente, tanto los exosomas como los MV se clasifican como vesículas extracelulares con tamaños similares; ambos son secretados por osteoblastos y tienen funciones compartidas durante la comunicación célula-célula.

Caracterización de vesículas que contienen minerales. (A y B) Imágenes de partículas de alta resolución antes (A) y después (B) de la eliminación de células cultivadas en medio osteogénico durante 7 días. Los mapas de pseudocolor de imágenes de partículas ampliadas indicadas por flechas rojas se muestran en el lado derecho de (B). Las partículas muestran estructuras muy lisas sin cristales. (C) Imágenes de microscopía electrónica de barrido (SEM) y análisis espectrométrico EDX de partículas en una película de SiN. La imagen SEM en el lado izquierdo muestra la película de SiN después de la eliminación de células cultivadas en medio normal, que no muestra partículas, y los datos espectrométricos de EDX no muestran picos de fósforo y calcio. A diferencia de, la imagen SEM y los datos espectrométricos EDX en el lado derecho muestran partículas y picos agudos de fósforo y calcio después del cultivo en medio osteogénico. (D) Análisis de elementos de partículas mediante mapas espectrométricos EDX. Las partículas contenían fósforo, calcio, carbón, y nitrógeno. (E) Espectros Raman obtenidos de osteoblastos cultivados con o sin medio osteogénico durante 23 días. El pico agudo de 960 cm − 1 fue evidente solo en el medio osteogénico (lado derecho). a.u., unidades arbitrarias. (F) Comparación de imágenes SE-ADM de osteoblastos knockout (KO) de Alpl en medios normales y osteogénicos. Las partículas desaparecieron por completo en medios osteogénicos. (G) Espectro EDX de partículas de osteoblastos Alpl KO en una película de SiN. Los datos espectrométricos de EDX del lado izquierdo muestran la película de SiN después de la eliminación de células cultivadas en medios normales, que no presentan picos de fósforo y calcio. Es más, las partículas en los medios osteogénicos de los datos del lado derecho no muestran picos de fósforo y calcio. Barras de escala, 1 μm en (A), (C, cima), (D), y (F); 200 nm en (B); 100 nm en (B, Derecha). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
En el siguiente paso, Iwayama y col. examinó si estas partículas eran MV que contenían calcio y / o fosfato. Para esto, cultivaron las células en medio osteogénico durante 7 días y las observaron usando SE-ADM para registrar estructuras muy lisas sin facetas cristalinas. Esto sugirió que las VM no cristalizaron sino que permanecieron amorfas como también se registró en un estudio anterior. Cuando los científicos examinaron las MV en una película de SiN (mononitruro de silicio), observaron picos agudos correspondientes al fósforo, calcio, elementos de carbono y oxígeno. Confirmaron los hallazgos utilizando espectroscopía Raman para mostrar la presencia de fosfato de calcio dentro de las VM.
Los científicos también investigaron los efectos de la hipofosfatasia, una condición médica codificada por el Gen Alpl (fosfatasa alcalina) , en donde los osteoblastos no experimentan mineralización in vitro. Para esto, editaron el genoma de las células de osteoblastos utilizando la tecnología de edición del genoma CRISPR-Cas9 para generar clones de osteoblastos knockout de Alpl. Cuando Iwayama et al. examinó los clones knockout utilizando SE-ADM de alta resolución, no observaron MV, que se confirmó además mediante análisis espectrométrico debido a la ausencia de picos de fósforo y calcio.
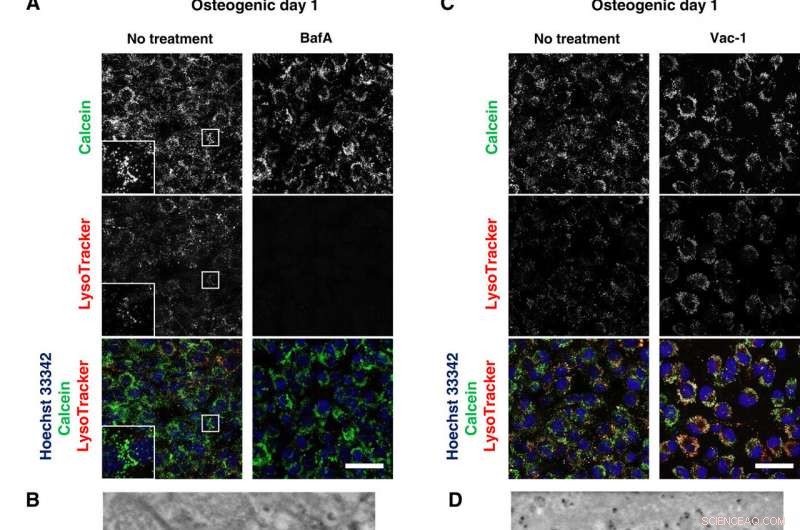
Los inhibidores lisosomales bloquean la mineralización. (A y C) Imágenes en vivo confocales de osteoblastos tratados con BafA 50 nM o Vac-1 10 μM. Las células se cultivaron en medios osteogénicos que contenían BafA o Vac-1 y se tiñeron con Hoechst 33342 y los insertos LysoTracker muestran un aumento mayor y un área en caja de cada canal. (B y D) Imágenes SD-ADM de osteoblastos tratados con BafA o Vac-1. Las células se cultivaron en medio osteogénico que contenía BafA o Vac-1. (E) Tinción con Alizain Red S realizada sin fijación. Las células se cultivaron en medios osteogénicos que contenían BafA o Vac-1 y se tiñeron con Alizain Red S. Imágenes confocales representativas. Barras de escala, 50 μm en (A), (C), y (E); 2 μm (B) y (D). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
Después de observar directamente la producción y secreción de MV utilizando SE-ADM, los científicos investigaron más a fondo la participación de los lisosomas en el tráfico intracelular de MV para observar la mineralización de osteoblastos vivos. Cultivaron las células en un medio osteogénico que contenía calcio y las tiñeron con LysoTracker para detectar los componentes intracelulares de interés. Iwayama y col. localizó las vesículas llenas de calceína emparejadas con lisosomas para sugerir la biogénesis de MV dentro de los lisosomas después de su fusión con calceína + vesículas. Los científicos siguieron los experimentos con la pérdida de función y los estudios de inhibición funcional para deconstruir aún más las vías y examinar los mecanismos de acción intracelulares durante la mineralización de células vivas in vitro.
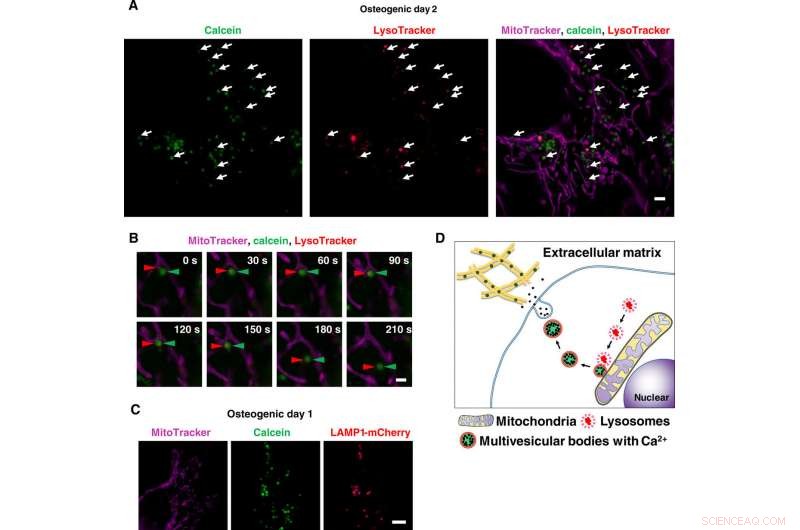
Imágenes en vivo de súper resolución de transportes de vesículas que contienen calcio a través de lisosomas. (A) Instantánea de imágenes SRM de lapso de tiempo de osteoblastos marcados con calceína. Las células se cultivaron con calceína y se tiñeron con Lysotracker y MitoTracker. Las flechas blancas indican la colocalización de lisosomas y vesículas positivas a calceína. (B) Primer plano de imágenes SRM de lapso de tiempo de osteoblastos marcados con calceína. Las puntas de flecha rojas indican lisosoma, y las puntas de flecha verdes indican calceína. Una vez que los lisosomas se fusionaron con vesículas positivas para calceína adyacentes a las mitocondrias, comenzaron a moverse hacia el espacio extracelular. (C) Imagen SRM representativa de células que expresan LAMP1-mCherry. Las células se transfectaron con el plásmido LAMP1-mCherry, cultivado con calceína, y teñido con MitoTracker. Calcein-positive vesicles matched to LAMP1-mCherry–positive lysosomes. (D) Schematic view of lysosomal involvement in transportation of calcium in mineralizing osteoblasts. Barras de escala, 2 μm in (A), 1 μm in (B), and 10 μm in (C). Crédito:Science Advances, doi:10.1126/sciadv.aax0672
Scientists had previously reported the involvement of mitochondria during mineralization due to the presence of electron-dense calcium and phosphorous-rich granules in osteoblast mitochondria. This was observed with a modified cryotechnique. Es más, reports also suggest the direct contact of lysosomes and mitochondria with functional significance. When Iwayama et al. stained cells with LysoTracker together with MitoTracker and observed the intracellular components under N-SIM structured illumination super-resolution microscopy (SRM). They observed the presence of most calcein-fulfilled vesicles next to mitochondria and matched with lysosomes. During SRM-time lapse imaging, the scientists further obtained views of intracellular transport of LysoTracker containing vesicles fused to static calcein vacuoles adjacent to mitochondria to validate their hypothesis.
De este modo, together with observations of other SRM systems and additional cell lines, Tomoaki Iwayama and colleagues proposed a mineralization mechanism. Wherein lysosomes played a central role in intracellular MV biogenesis and trafficking within osteoblasts. It was reasonable to involve lysosomes for osteoblasts to transport amorphous calcium phosphate without crystallization during its transport in the cytosol. The scientists aim to conduct further experiments to understand the regulatory molecules for MVs and investigate if MVs and exosomes have similar constitutions and mechanism underlying their generation, secretion and function. The SE-ADM strategy used in the present work can be installed into existing scanning electron microscopy apparatus at a low cost. The work developed in the study will offer non-invasive, high-resolution imaging at the nanoscale applicable to all scientific fields.
© 2019 Science X Network