Durante la electrólisis del agua, la electricidad pasa a través del agua para dividirla en otras sustancias. En la reacción deseada, el agua líquida (H2O) se divide en oxígeno gaseoso (O2) e hidrógeno gaseoso (H2). En agua salada El cloruro de sodio (NaCl) está presente como iones de sodio y cloro disueltos (Na + y Cl - ). En este caso, una segunda reacción también puede ocurrir durante la electrólisis, en el que los iones de cloro se convierten en cloro gaseoso (Cl 2 ). Crédito:Universidad de Leiden
El grupo de investigación dirigido por el químico de Leiden Marc Koper ha descubierto un catalizador que minimiza la producción de cloro gaseoso durante la electrólisis del agua salada. La invención puede permitir la producción directa de hidrógeno a partir de agua de mar. El artículo ha sido publicado en la Revista de la Sociedad Química Estadounidense .
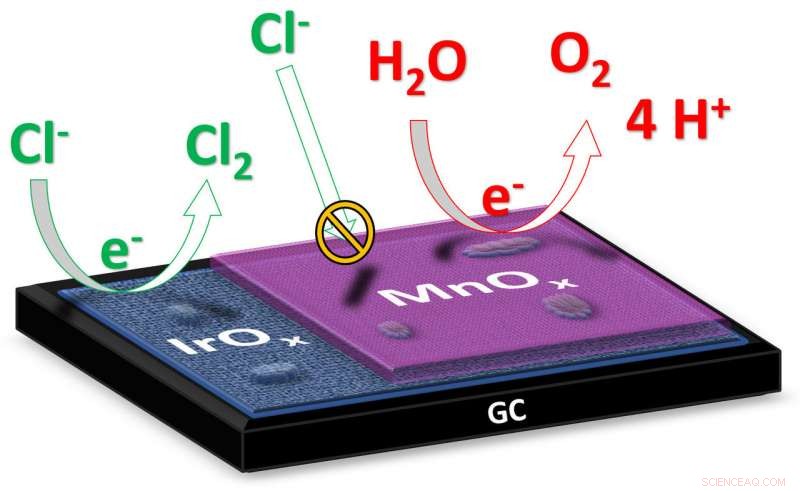
"En la electrólisis del agua salada, como el agua de mar, el objetivo final es producir hidrógeno en el cátodo, "explica el estudiante de doctorado Jan Vos del Instituto de Química de Leiden." El producto formado en el ánodo es idealmente oxígeno, porque es inofensivo para el medio ambiente ". Sin embargo, durante la electrólisis del agua salada también se puede formar gas cloro tóxico en el ánodo. Los investigadores ahora han producido un catalizador que minimiza la formación de cloro gaseoso a favor de la formación de oxígeno. Vos explica:"El catalizador consta de dos óxidos metálicos:óxido de iridio con una capa de óxido de manganeso de solo una docena de nanómetros de espesor. El iridio es un material que exhibe una alta actividad catalítica para la formación de gas oxígeno y gas cloro; el óxido de manganeso actúa como una especie de membrana que evita el suministro de iones de cloruro y suprime la formación de cloro gaseoso ".
La electrólisis del agua es un paso importante para la producción y el uso de hidrógeno como portador de energía alternativo. Un ánodo que contrarresta la formación de cloro gaseoso permite la electrólisis del agua donde no es necesario eliminar primero la sal disuelta del agua. cuyo proceso sigue costando importantes cantidades de energía y capital. Permitiría la producción directa de hidrógeno a partir del agua de mar, aliviando así las escasas reservas de agua dulce en la tierra.
Según Vos, Un efecto secundario útil de la electrólisis del agua salada es la producción de agua dulce muy pura. "Si el gas de hidrógeno extraído se utiliza finalmente como combustible, por ejemplo en una pila de combustible de un coche, el hidrógeno reacciona de nuevo al agua con oxígeno gaseoso de la atmósfera. De esa manera, La aplicación a gran escala de electrólisis de agua e hidrógeno en pilas de combustible dará lugar a grandes cantidades de este "producto de desecho":agua pura. En un futuro en el que la escasez de agua se convierta en un problema cada vez más grave, esto ciertamente no sería indeseable ".
La investigación arroja nueva luz sobre una cuestión de química que ha estado sucediendo durante décadas. "Originalmente no teníamos idea de por qué los materiales basados en óxido de manganeso tenían una selectividad tan alta hacia el oxígeno. Supusimos que era una propiedad puramente catalítica del material, pero posibles efectos de las barreras de difusión:el bloqueo selectivo del transporte de iones cloruro ... ¡Eso ni siquiera se me ocurrió! De hecho, es un muy básico, solución eficaz a un problema muy complejo. Eso ha cambiado radicalmente la dirección de nuestra investigación ".
El descubrimiento tiene implicaciones para la selectividad en la electrólisis. La selectividad es un criterio importante para determinar qué tan bien funciona un convertidor catalítico. En muchos procesos (electro) químicos, es posible formar diferentes productos durante una reacción, pero se espera que solo se forme el producto requerido. La forma de influir en la selectividad suele ser seleccionar el catalizador con mucha precisión y ajustarlo, pero esto requiere mucho tiempo y dinero. Es más, no siempre es posible combinar una alta selectividad con una alta actividad, otra característica importante.
Según Vos, la investigación encaja muy bien en un emergente, Tendencia alternativa en electrocatálisis:el uso de ciertos recubrimientos para mejorar un catalizador. "Tal capa evita que los reactivos no deseados lleguen al catalizador. Esto permite que un material catalítico activo pero no selectivo se haga selectivo de una manera alternativa".