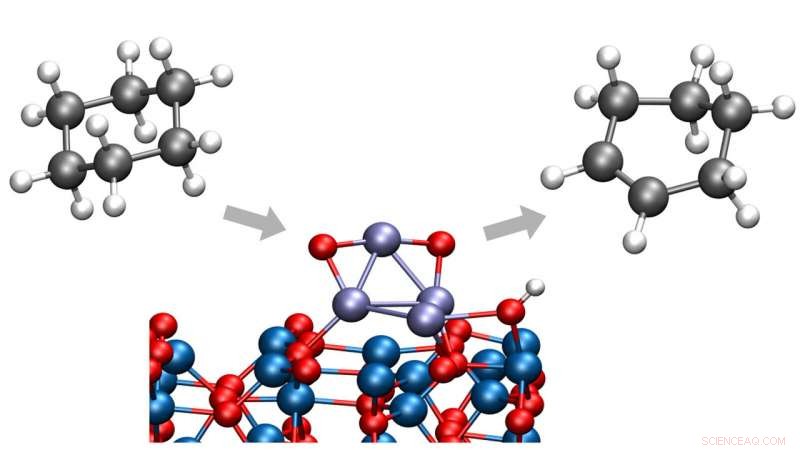
Los químicos del argón han identificado una forma de convertir el ciclohexano en ciclohexeno o ciclohexadieno, Ambos productos químicos importantes en una amplia gama de procesos industriales. El nuevo proceso se realiza a bajas temperaturas, eliminando la creación de subproductos no deseados. Crédito:Laboratorio Nacional Argonne
Los químicos dedican una gran cantidad de tiempo y energía a intentar que las reacciones químicas comiencen o se aceleren, pero a veces puede ser igualmente importante detenerlas antes de que vayan demasiado lejos.
En un estudio reciente del Laboratorio Nacional Argonne del Departamento de Energía de EE. UU. (DOE), los químicos han identificado una forma de convertir el ciclohexano en ciclohexeno o ciclohexadieno, sustancias químicas importantes en una amplia gama de procesos industriales. En tono rimbombante, este proceso se lleva a cabo a bajas temperaturas, eliminar la creación de dióxido de carbono que habría resultado de una ruptura no deseada de los enlaces carbono-carbono.
El ciclohexano es una molécula de partida importante en una amplia gama de reacciones químicas, según el químico de Argonne Stefan Vajda, ahora en el Instituto de Química Física J. Heyrovský en Praga. Sin embargo, sin un catalizador adecuado para iniciar la reacción, convertir el ciclohexano en productos útiles normalmente requiere temperaturas elevadas generadas mediante el gasto de una gran cantidad de energía, y el proceso también puede sufrir de una selectividad deficiente.
En el estudio, El químico de Vajda y Argonne, Larry Curtiss, y su equipo internacional de colaboradores examinaron un tipo de reacción llamada deshidrogenación oxidativa. en el que las moléculas de hidrógeno se eliminan de una molécula más grande. Al cortar un número limitado de enlaces hidrógeno-carbono, la reacción puede producir ciclohexeno y ciclohexadieno antes de que tenga lugar la combustión a dióxido de carbono.
El trabajo mejoró los estudios previos del equipo de Argonne sobre la deshidrogenación de ciclohexano y ciclohexeno al introducir dos componentes clave:un catalizador de óxido de cobalto de tamaño sub-nanométrico sobre un soporte de óxido de aluminio y un ambiente de oxígeno controlado.
Los investigadores emplearon técnicas de dispersión de rayos X en Advanced Photon Source (APS) de Argonne, una instalación para usuarios de la Oficina de Ciencias del DOE, para monitorear la naturaleza y estabilidad de los catalizadores durante la prueba catalítica de los clusters en tiempo real. Descubrieron que los grupos llevaban a cabo una deshidrogenación parcial del ciclohexano a temperaturas de alrededor de 100 grados Celsius, mucho más bajas de lo que se había observado anteriormente para este tipo de reacción. y los racimos retuvieron su naturaleza oxidada y estabilidad a temperaturas de reacción de hasta 300 ° C.
"El hecho de que podamos hacer que esta conversión suceda a temperaturas más bajas protege los productos de deshidrogenación intermedios ciclohexeno y ciclohexadieno para que no se conviertan en productos no deseados, "Dijo Vajda.
Vajda y Curtiss señalaron que el catalizador altamente selectivo es de larga duración y no se envenena ni se degrada por la reacción. En la investigación teórica y experimental del tamaño del catalizador, los investigadores encontraron que los grupos de tamaño cuatro y veintisiete átomos eran aproximadamente igualmente eficientes en llevar a cabo la reacción. "Parece que mientras el catalizador tenga un tamaño inferior a aproximadamente un nanómetro, esta composición funciona bien, un factor importante para el posible aumento de escala de esta clase de catalizadores por métodos más tradicionales, aunque menos selectivo por tamaño, rutas de síntesis ", dijo Vajda.
Para comprender mejor los mecanismos básicos detrás de la actividad y selectividad de los catalizadores de cobalto, los investigadores utilizaron cálculos de la teoría funcional de la densidad para modelar las vías de reacción. "El excelente rendimiento de los grupos de cobalto se puede explicar mediante cálculos teóricos, que revelan átomos de cobalto altamente activos en los grupos y muestran que la naturaleza oxidada de los grupos provoca la formación a baja temperatura del producto, "Curtiss explicó.