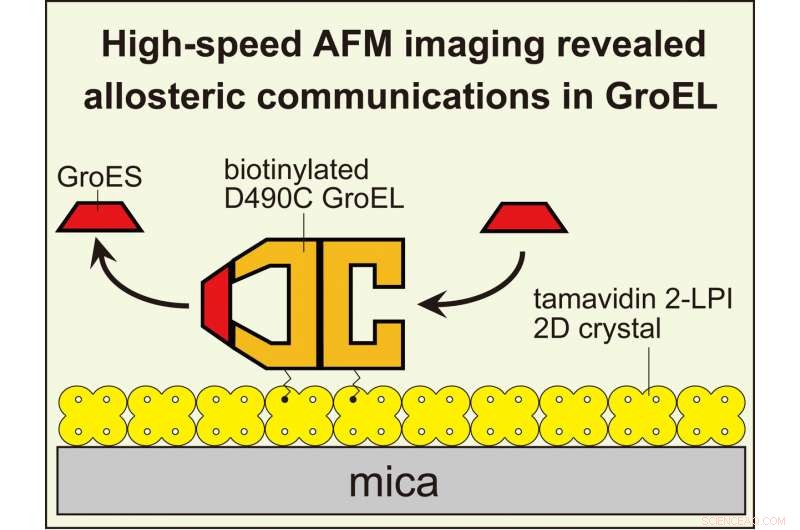
Las imágenes de HS-AFM revelaron comunicaciones entre anillos alostéricos en GroEL que gobiernan su reacción de chaperonina. Para visualizar interacciones dinámicas GroEL-GroES con AFM de alta velocidad, GroEL biotinilado en sus dominios ecuatoriales se ató al cristal bidimensional de tamavidina 2-LPI formado directamente en la superficie de la mica. Crédito:Universidad de Kanazawa
Las proteínas deben plegarse de una manera específica para funcionar. A menudo, esto es asistido por chaperonas moleculares, pequeñas proteínas cuya función es ayudar a otros a plegarse a la forma correcta. Ahora, Investigadores japoneses han descubierto que para una chaperona molecular al menos, hay más en el proceso de lo que se sospechaba.
En un papel en Transacciones filosóficas de la Royal Society , el grupo liderado por Kanazawa se centró en GroEL, que es vital para el plegamiento de proteínas en las bacterias. Se entiende el esquema general:GroEL captura una proteína objetivo desplegada (el sustrato) dentro de una cavidad, donde se pueda plegar correctamente sin agregarse. Sin embargo, los detalles mecanicistas son difíciles de desentrañar con los métodos conjuntos tradicionales. En el nuevo estudio, Se utilizó microscopía de fuerza atómica de alta velocidad (HS-AFM) para visualizar eventos de manera más directa.
GroEL es una molécula en forma de cilindro, hecho de dos anillos apilados espalda con espalda. Un socio clave en su función es GroES, una "co-chaperonina" en forma de anillo que se une a cada extremo de GroEL como una tapa abovedada. Solo cuando GroEL está cubierto por GroES puede atrapar la proteína del sustrato. Luego, cuando se completa el plegado, GroES se disocia de GroEL, y se libera el sustrato plegado.
Donde se vuelve nebuloso es cómo cooperan los dos anillos en cada extremo de GroEL. Los anillos son idénticos y ambos pueden ser limitados por GroES. Cuando solo se tapa un extremo, el complejo resultante se denomina "bala", en virtud de su apariencia puntiaguda. Mientras tanto, el formulario con ambos extremos tapados se denomina "fútbol", ya que su forma ovalada simétrica se asemeja a una bola de parrilla.

Eventos de asociación y disociación de GroES capturados por imágenes de HS-AFM. Aunque la reacción procede principalmente de forma alternativa a B? ? F? ¿B? ? F (B y F representan complejos de bala y fútbol, respectivamente, y las flechas verticales indican la polaridad de los complejos de bala), ocasionalmente ocurre de diferentes maneras. Crédito:Universidad de Kanazawa
"En un modelo convencional, el ciclo de taponamiento, plegamiento de proteínas, y destapando se alterna entre cada anillo, ", dice el coautor del estudio, Daisuke Noshiro." El taponamiento en un anillo de GroEL (que tiene estereoquímica cis) evita el taponamiento simultáneo en el otro extremo (trans). Esta comunicación intramolecular se conoce como alosterio ". En este punto de vista, la bala de un solo casquillo es la forma activa de GroEL, y el fútbol es simplemente un intermedio de corta duración entre ciclos.
Otros hallazgos, aunque, han insinuado una mayor complejidad, lo que ha sido destacado por este nuevo estudio. Dependiendo del tipo de sustrato, GroEL apareció como una pelota de fútbol, en lugar de una bala, hasta el 67% del tiempo, lo que implica una ruptura de la regulación alostérica negativa. Esto era más común cuando el sustrato era una proteína desplegable o no había ningún sustrato, pero incluso con sustratos plegables, Abundaban los complejos de fútbol.
Más inesperadamente, el ciclo se produjo por dos vías diferentes. En el predominante Tipo I, cuando el anillo activo de GroEL completa su tarea y el otro extremo toma el testigo, los dos anillos también intercambian conformaciones cis y trans. Sin embargo, alrededor del 25% del tiempo (en Tipo II), las conformaciones no se intercambian, interrumpiendo la circular, ritmo alterno de Tipo I. No obstante, todavía se produce el plegamiento de proteínas. Los balones de fútbol prevalecen en ambos casos.
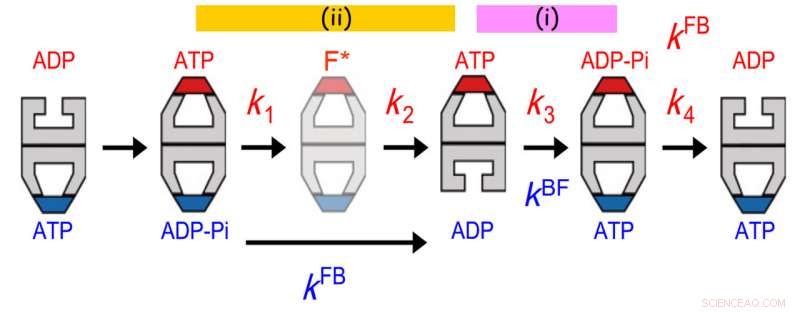
Comunicaciones alostéricas entre dos anillos de GroEL. La distribución de la vida útil de GroES ligado se ajustó mejor a un modelo de reacción secuencial de cuatro pasos con cuatro constantes de velocidad, k1, k2, k3 y k4. El valor de k3 coincidió con el de la tasa de transición de bala a fútbol (kBF) en el anillo opuesto. Es más, el valor de 1 / k1 + 1 / k2 coincidió con el de 1 / kFB (kFB, la tasa de transición de fútbol a bala en el anillo opuesto). El acuerdo anterior indica que la hidrólisis de ATP en ADP-Pi en un anillo actúa como un guardián del tiempo para la liberación de ADP del anillo trans opuesto, asegurando la liberación de la proteína del sustrato del anillo trans antes de que se cubra con GroES. El último acuerdo indica que un evento que ocurre en el segundo paso después de la unión de ATP desencadena la liberación de Pi del anillo opuesto. Crédito:Universidad de Kanazawa
"La estructura del fútbol es tan abundante, debe desempeñar un papel más activo de lo que pensamos, ", dice el autor correspondiente Toshio Ando." Este complejo mecanismo es importante, porque las chaperoninas son una clase natural de máquinas moleculares. Las sutilezas de GroEL pueden ayudarnos a comprender el papel del alosterio en las máquinas moleculares de manera más general ".