La disminución de los recursos energéticos convencionales basados en combustibles fósiles y sus consecuencias ambientales relacionadas han llamado la atención en todo el mundo hacia el desarrollo de recursos energéticos renovables. Es posible que estos recursos de energía renovable no satisfagan todas las demandas energéticas de la población masiva del mundo; sin embargo, limitan los efectos de los gases de efecto invernadero y la contaminación del aire causada por la quema de combustibles fósiles. Entre los recursos alternativos, el hidrógeno se considera el portador de energía más limpio.
Sin embargo, el hidrógeno no existe en estado puro en la naturaleza, como el oxígeno, y debe producirse a partir de recursos que contienen hidrógeno, como el gas natural (metano), el carbón, la biomasa y el agua, mediante reformado, descomposición térmica o electrólisis. Pero la producción de hidrógeno a partir de gas natural, carbón y biomasa conduce a la emisión del gas de efecto invernadero dióxido de carbono (CO2 ).
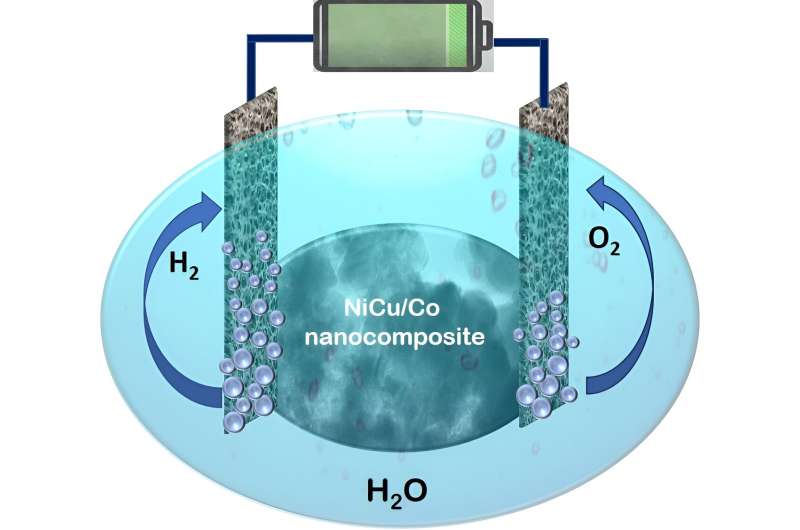
Sabemos que el agua (H2 O) está formado por átomos de hidrógeno y oxígeno; por tanto, el agua de mar podría ser una fuente ilimitada de hidrógeno. Por tanto, el hidrógeno se visualiza como un posible sustituto de los combustibles fósiles. La producción de energía a partir de energías renovables (utilizando energía eólica, solar, hidráulica, undimotriz o similar) se denomina "hidrógeno verde". En este escenario, una de las técnicas propuestas es dividir el agua en hidrógeno y oxígeno utilizando electricidad renovable en un electrolizador sobre la superficie de un electrocatalizador robusto.
A pesar de los avances en este campo, el proceso de escupir agua para producir hidrógeno verde asequible sigue siendo lento debido a limitaciones relacionadas con los electrocatalizadores eficientes. En teoría, el agua se divide a 1,23 V. Sin embargo, en términos prácticos, este valor es superior a 1,5 V (lo que significa un desperdicio de energía adicional). Esta energía mínima es teóricamente necesaria para romper la molécula de agua. Para este proceso se utilizan en el electrolizador costosos electrocatalizadores a base de metales nobles y preciosos, como por ejemplo Pt, Pd, Au, Rh, Ir, etc.
El principal problema al que se enfrenta la industria y los expertos es la oxidación del agua para producir O2 y la estabilidad del catalizador en duras condiciones alcalinas industriales. En el primer problema, la reacción de media celda es una reacción cuesta arriba donde están involucrados cuatro electrones y donde se requiere la mayor parte de la energía aparte de la pérdida de energía asociada a la resistividad de los diferentes componentes (electrolito, conexiones, catalizador, etc.) de el electrolizador. En el segundo problema, los costosos catalizadores pierden a menudo su actividad debido a la degradación de la superficie. En estas condiciones, se requiere un electrocatalizador barato y asequible pero altamente activo y estable para dicha reacción de división del agua.
En un estudio reciente, nuestro equipo, dirigido por Sasanka Deka, diseñó y desarrolló un nuevo electrocatalizador basado en nanocompuestos, altamente eficiente pero aún rentable, para la división general del agua. Un nanocompuesto es una mezcla homogénea de dos o más materiales presentes en el rango nanométrico. El presente nanocompuesto es una nanoarquitectura basada en nanopartículas desaleadas de NiCu sobre nanohojas de Co jerárquicas. Nuestros hallazgos se publican en la revista ACS Catalysis. .
Los materiales utilizados son más baratos que los metales preciosos y el procedimiento de síntesis es muy cómodo. Este nuevo catalizador se utilizó en un electrolizador en electrolito de hidróxido de potasio (KOH) para la división del agua. Curiosamente, el sistema muestra la división del agua y la producción de gas hidrógeno utilizando el electrocatalizador NiCu/Co con un voltaje de celda de 1,46 V. Así, el electrocatalizador es capaz de descomponer el agua utilizando únicamente una batería doméstica de 1,5 voltios.
Otros puntos clave del electrocatalizador de NiCu/Co son la producción de hidrógeno verde que se produce con una alta densidad de corriente, una alta estabilidad (6.000 ciclos) y una durabilidad (60 h) del catalizador, importantes desde el punto de vista industrial. También funciona con electrolitos industriales con un 30 % en peso de electrolito KOH y el voltaje de celda ofrecido es mucho más bajo que el de un IrO2 comercial. ||Catalizador Pt/C.
Se han realizado estudios experimentales y computacionales detallados para comprender la razón detrás de esta eficiencia. Los resultados corroborados apoyan nuestra hipótesis inicial de lixiviación selectiva de materiales para hacer una estructura más porosa, y el uso de diferentes centros metálicos y formas de materiales para la evolución de hidrógeno y oxígeno.
En resumen, hemos desarrollado un método simple pero avanzado y rentable para diseñar un electrocatalizador bifuncional basado en nanocompuestos de NiCu desaleado en nanohojas de Co que puede dividir agua a 1,46 V con gran estabilidad. Esperamos que nuestro producto pueda ser útil para la síntesis a escala y el uso comercial en electrolizadores para la producción de hidrógeno verde.
Esta historia es parte de Science X Dialog, donde los investigadores pueden informar los hallazgos de sus artículos de investigación publicados. Visite esta página para obtener información sobre ScienceX Dialog y cómo participar.
Más información: Ankur Kumar et al, Diseño de nanoarquitectura de nanopartículas desaleadas de NiCu en nanohojas de Co jerárquicas para la división general de agua alcalina a bajo voltaje de celda, Catálisis ACS (2023). DOI:10.1021/acscatal.3c02096
Información de la revista: Catálisis ACS
La Dra. Sasanka Deka es profesora de Química en la Universidad de Delhi. Recibió su doctorado. Licenciatura del Laboratorio Químico Nacional (NCL-Pune). Realizó su investigación postdoctoral en el Laboratorio Nacional de Nanotecnología, CNR-INFM, Lecce, Italia y el Instituto Italiano de Tecnología (IIT), Génova, Italia. Ha sido galardonado con el PREMIO SHRI RAM ARORA 2008 de la Fundación TMS, otorgado por la Minerals, Metals &Materials Society (TMS), Warrendale, EE.UU.; Premio DAE-BRNS a la investigación para jóvenes científicos 2011, mejor charla oral de RSC - 2015, Instituto de Física (IOP), artículo mejor citado del Reino Unido - India 2019 y artículo mejor citado de RSC en 2020. El Dr. Deka ha publicado más de 75 artículos de investigación en diferentes revistas internacionales de alto impacto, posee tres patentes y también escribió dos libros y tres capítulos de libros publicados por una editorial internacional. Ha manejado con éxito varios proyectos de investigación extramuros nacionales e internacionales. Su interés de investigación actual se centra en la nanoquímica sintética y los nuevos nanomateriales para la investigación energética.