
Las transfusiones de plaquetas son esenciales para controlar el sangrado y la disfunción hemostática, y pueden ampliarse para usarse como terapia celular para una variedad de enfermedades. Los esfuerzos para crear este tipo de terapias celulares requieren que los investigadores modifiquen las plaquetas de los donantes para que expresen proteínas terapéuticas. Sin embargo, en la actualidad, los métodos apropiados para modificar genéticamente las plaquetas extraídas de donantes de sangre siguen siendo difíciles de alcanzar.
En un nuevo estudio publicado en Science Advances , Jerry Leung y un equipo de científicos en nanomedicina, bioquímica y biología molecular de la Universidad de Columbia Británica (Canadá), la Universidad de Hokkaido (Japón) y varias instituciones de EE. UU. describieron un enfoque basado en nanopartículas lipídicas optimizadas para plaquetas que contienen ARNm. para la expresión de proteínas exógenas en plaquetas humanas y de rata.
Cuando el equipo probó la biblioteca de nanopartículas de lípidos de ARNm, la expresión de proteínas exógenas resultante no se correlacionó con la activación plaquetaria. Las plaquetas transfectadas conservaron la función hemostática y se acumularon en áreas de daño vascular después de la transfusión en ratas con la capacidad de ampliar el potencial terapéutico de las plaquetas.
Las plaquetas son parte integral de la hemostasia y se transfunden de forma rutinaria para restablecer el equilibrio hemostático en los pacientes. Estas plaquetas se pueden expandir más allá de indicaciones como terapias celulares para tratar la sepsis, la inflamación y la artritis. Las plaquetas genéticamente modificadas pueden crear nuevas terapias celulares que expresen proteínas terapéuticas, que pueden implementarse para modificar las plaquetas de los donantes. Los métodos existentes de electroporación, vectores virales y transfección comercial no han podido editar plaquetas de donantes ni expresar proteínas exógenas.
Los enfoques indirectos pueden expresar proteínas exógenas en plaquetas o partículas similares a plaquetas dirigiéndose a las células madre precursoras de plaquetas con vectores lentivirales. Las plaquetas derivadas de donantes deben modificarse funcionalmente para crear auténticas terapias con células plaquetarias.
Intentos anteriores de transfectar plaquetas con nanopartículas lipídicas que contienen ARNm han demostrado la posibilidad de administrar ARNm a las plaquetas, mientras que los avances en la tecnología de nanopartículas lipídicas han mejorado su potencial para llegar a un grupo demográfico más amplio.
En este trabajo, Leung y sus colegas informaron sobre las nanopartículas lipídicas de ARNm por su capacidad para transfectar directamente plaquetas de donantes para expresar proteínas exógenas. Estas plaquetas se pueden modificar con nanopartículas lipídicas de ARNm para mantener su función y acumularse localmente en las heridas y regular la homeostasis después de la transfusión en ratas coagulopáticas.
Para identificar los métodos de transfección eficaces para las plaquetas, el equipo entregó ARNm que codifica una enzima NanoLuc luciferasa (NanoLuc) utilizando varios agentes de transfección y midió su expresión. Si bien NanoLuc no se detectó en plaquetas tratadas con ARNm libre sin un agente de transfección o mediante el uso de agentes comerciales de administración de ARNm, el proceso permitió la absorción de grandes cantidades de ARNm en las plaquetas.
Leung y su equipo detectaron la expresión de NanoLuc mediante el uso de una formulación de nanopartículas de lípidos de ARNm que se parecía a la pequeña nanopartícula de lípidos de ARN de interferencia clínicamente probada para tratar la amiloidosis hereditaria. El equipo comparó la cantidad de activación plaquetaria después de la transfección de nanopartículas lipídicas de ARNm con plaquetas no tratadas.
Para identificar la formulación de nanopartículas lipídicas de ARNm más adecuada para transportar plaquetas, optimizaron tres componentes principales; lípidos ionizables, lípidos enlazadores y el lípido polietilenglicol. Examinaron 10 lípidos ionizables y dos catiónicos permanentes y midieron su expresión de proteínas, absorción de ARNm y activación para respaldar la síntesis de proteínas.
Acciones de las nanopartículas lipídicas funcionalizadas en el laboratorio
Para examinar cómo la combinación de lípidos ionizables y auxiliares tiene efectos sinérgicos para mejorar la expresión de proteínas y al mismo tiempo minimizar la activación plaquetaria, el equipo estudió dos lípidos ionizables aprobados por la FDA. Además de su composición lipídica, los elementos del ARNm desempeñaron un papel importante para promover la síntesis eficiente de proteínas exógenas. Las nanopartículas lipídicas que contienen lípidos auxiliares con una cabeza de fosfocolina, junto con lípidos con grupos de cola ramificados o insaturados, fueron las más adecuadas para la transfección de plaquetas y para impulsar niveles de expresión más altos.
De las modificaciones de ARN probadas en este trabajo, Leung y sus colegas observaron que la uridina o pseudouridina no modificada facilita niveles más altos de expresión de fluorescencia. Luego observaron si la expresión de la fluorescencia dependía del grado de activación plaquetaria o de la cantidad de ARN liberado, lo que estudiaron mediante un análisis de matriz de correlación.
Si bien la expresión de fluorescencia no se correlacionó fuertemente con los niveles de plaquetas en la superficie o la absorción de ARNm, observaron una leve correlación positiva entre la cantidad de ARN administrado y la activación de las plaquetas. Dado que la expresión de NanoLuc no se correlacionaba fuertemente ni con los niveles de plaquetas en la superficie ni con la absorción de ARNm, el equipo probó la posibilidad de influir en su expresión activando las plaquetas usando agonistas antes y después de la transfección de nanopartículas lipídicas de ARNm.
Las plaquetas estimuladas con difosfato de adenosina, por ejemplo, péptido relacionado con colágeno reticulado o trombina antes del tratamiento con nanopartículas lipídicas de ARNm, tenían una expresión de fluorescencia significativamente menor. Cuando Leung y el equipo estimularon las plaquetas con agonistas durante más de dos horas, sufrieron una reorganización sustancial del transcriptoma y el proteoma. Los resultados mostraron que la traducción del ARNm exógeno no requería activación plaquetaria.
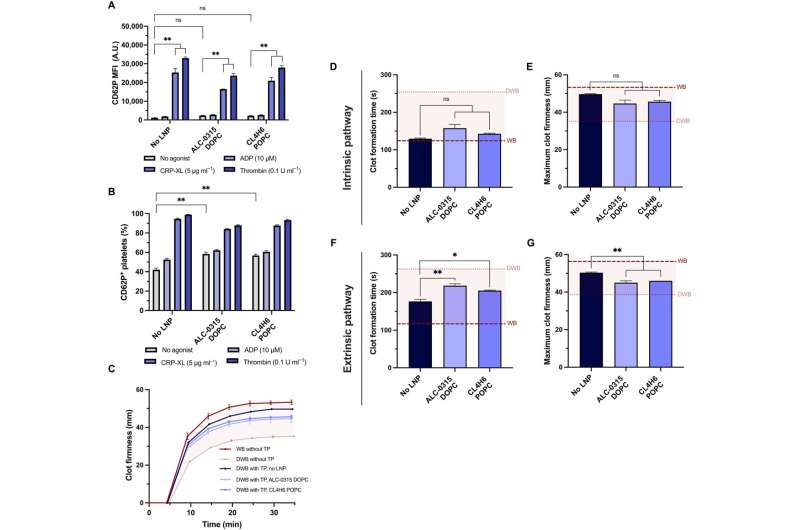
Cuando el equipo trató las plaquetas con nanopartículas lipídicas de ARNm, mantuvieron la función hemostática in vitro y mostraron una alta sensibilidad a sus entornos físicos y químicos. El equipo investigó si las plaquetas aún podían activarse después de la transfección de nanopartículas de ARNm y lípidos y midió su estado de activación y respuesta a agonistas fisiológicos.
El equipo probó la capacidad de las plaquetas transfectadas para conservar su potencial de contribuir a la firmeza y la velocidad de formación de coágulos utilizando un modelo de tromboelastometría rotacional y un modelo ex vivo para probar la actividad plaquetaria en sangre total. Los investigadores modelaron la coagulopatía por dilución utilizando sangre entera diluida y plaquetas preparadas en un paquete de transfusión.
Cuando combinaron el paquete de transfusión con sangre total diluida para modelar la enfermedad tal como ocurre en un paciente, observaron que las nanopartículas lipídicas no afectaron la coagulopatía plaquetaria in vitro. Además, el equipo exploró la expresión de plaquetas transfectadas con nanopartículas lipídicas de ARNm expresadas con NanoLuc, circuladas y localizadas en los sitios de las heridas después de la transfusión en roedores coagulopáticos.
De esta manera, Jerry Leung y sus colegas se dirigieron a la administración de moléculas y terapias celulares en sitios de interés de la vasculatura mediante el uso de plaquetas naturalmente competentes que pueden realizar esta tarea de manera inherente. El equipo desarrolló nanopartículas lipídicas y ARNm optimizadas para plaquetas para una expresión exitosa de proteínas, al tiempo que presenta la función circular de las plaquetas y la acumulación local en el sitio de interés de la vasculatura.
Es posible lograr la entrega de ácidos nucleicos y la traducción exógena utilizando nanopartículas de lípidos de ARNm optimizadas para plaquetas para ampliar y diseñar plaquetas para una variedad de aplicaciones clínicas. Estas plaquetas de donantes diseñadas con nanopartículas de lípidos de ARNm pueden tratar trastornos hemorrágicos agudos con aplicaciones más amplias en oncología. Estas plaquetas transfundidas con nanopartículas de lípidos de ARNm optimizadas son funcionalmente transfundibles y pueden acumularse en el sitio de la vasculatura para terapias plaquetarias efectivas para modular los trastornos hematológicos.
Más información: Jerry Leung et al, Plaquetas transfundibles genéticamente modificadas utilizando nanopartículas lipídicas de ARNm, Science Advances (2023). DOI:10.1126/sciadv.adi0508
Información de la revista: Avances científicos
© 2023 Red Ciencia X