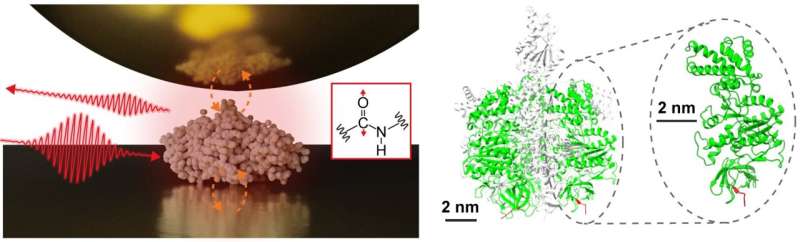
Un equipo de investigación interdisciplinario, dirigido por el profesor adjunto Jun Nishida y el profesor asociado Takashi Kumagai del Instituto de Ciencia Molecular, ha observado con éxito espectros vibratorios de proteínas individuales, que constan de aproximadamente 500 residuos de aminoácidos, utilizando técnicas de medición avanzadas basadas en microscopía óptica de campo. Este método utiliza luz confinada a escala nanométrica, lo que permite el análisis detallado de muestras extremadamente pequeñas, lo que anteriormente era un desafío con la espectroscopia infrarroja convencional.
El estudio se publica en la revista Nano Letters. .
La espectroscopia infrarroja convencional se ha utilizado ampliamente para el análisis estructural y químico de diversos materiales, ya que puede medir espectros vibratorios, a menudo denominados "huellas dactilares moleculares".
El nuevo logro representa un avance importante hacia innovaciones tecnológicas como las imágenes infrarrojas ultrasensibles y de súper resolución, así como la espectroscopia vibratoria de una sola molécula.
El rápido desarrollo de la nanotecnología en los últimos años ha llevado a una creciente demanda de imágenes infrarrojas de ultra alta sensibilidad y súper resolución. Sin embargo, la espectroscopia infrarroja convencional está limitada a la hora de medir muestras extremadamente pequeñas o lograr una resolución espacial a escala nanométrica. Por ejemplo, incluso la microespectroscopia infrarroja con buena sensibilidad requiere más de un millón de proteínas para obtener un espectro infrarrojo, lo que hace imposible medir una sola proteína.
En su estudio, el equipo de investigación aisló una única proteína, una subunidad que comprende un complejo proteico llamado F1 -ATPasa, sobre un sustrato de oro y realizó mediciones de espectroscopía infrarroja de campo cercano en un ambiente ambiente.
Adquirieron con éxito el espectro vibratorio infrarrojo de una sola proteína, lo que representa un avance importante que puede conducir a la caracterización de organizaciones estructurales locales de proteínas individuales. Esta información es particularmente importante para comprender las funciones sofisticadas de los complejos proteicos y las proteínas de membrana, ofreciendo conocimientos más profundos sobre sus mecanismos e interacciones.
Además, han desarrollado un nuevo marco teórico que describe las interacciones a nanoescala entre el campo cercano infrarrojo y las proteínas.
Basándose en la teoría, el equipo pudo reproducir cuantitativamente los espectros vibratorios experimentales que observaron. Estos resultados serán invaluables para el análisis químico de biomoléculas, así como de diversos nanomateriales, allanando el camino para una variedad de aplicaciones de espectroscopía infrarroja a nanoescala.
Más información: Jun Nishida et al, Interacciones de campo cercano con radio de punta secundaria en espectroscopia vibratoria Nano-FTIR en proteínas individuales, Nano letras (2024). DOI:10.1021/acs.nanolett.3c03479
Información de la revista: Nanoletras
Proporcionado por los Institutos Nacionales de Ciencias Naturales