Una nueva técnica de imágenes desarrollada por ingenieros de la Universidad de Washington en St. Louis puede brindar a los científicos una visión mucho más cercana de los conjuntos de fibrillas:pilas de péptidos que incluyen beta amiloide, especialmente asociado con la enfermedad de Alzheimer.
Estos conjuntos de fibrillas β cruzadas también son componentes útiles dentro de biomateriales de diseño para aplicaciones médicas, pero su parecido con sus primos beta amiloides, cuyos ovillos son un síntoma de enfermedades neurodegenerativas, es preocupante. Los investigadores quieren aprender cómo se relacionan las diferentes secuencias de estos péptidos con su diferente toxicidad y función, tanto para los péptidos naturales como para sus primos diseñados sintéticamente.
Ahora, los científicos pueden observar de cerca los conjuntos de fibrillas para ver que existen diferencias notables en cómo se apilan los péptidos sintéticos en comparación con la beta amiloide. Estos resultados surgen de una fructífera colaboración entre el autor principal Matthew Lew, profesor asociado de ingeniería eléctrica y de sistemas, y Jai Rudra, profesor asociado de ingeniería biomédica, en la Escuela de Ingeniería McKelvey de WashU.
"Diseñamos microscopios para permitir mejores mediciones a nanoescala para que la ciencia pueda avanzar", dijo Lew.
En un artículo publicado recientemente en ACS Nano , Lew y sus colegas describen cómo utilizaron la sonda química roja del Nilo para iluminar fibrillas β cruzadas. Su técnica, llamada microscopía de orientación y localización de molécula única (SMOLM), utiliza destellos de luz del rojo del Nilo para visualizar las estructuras de fibras formadas por péptidos sintéticos y beta amiloide.
La conclusión:estas asambleas son mucho más complicadas y heterogéneas de lo previsto. Esas son buenas noticias porque significa que hay más de una forma de apilar proteínas de forma segura. Con mejores mediciones e imágenes de los conjuntos de fibrillas, los bioingenieros pueden comprender mejor las reglas que dictan cómo la gramática de las proteínas afecta la toxicidad y la función biológica, lo que lleva a terapias más efectivas y menos tóxicas.
Primero, los científicos necesitan ver la diferencia entre ellos, algo muy desafiante debido a la pequeña escala de estos ensamblajes.
"La torsión helicoidal de estas fibras es imposible de discernir usando un microscopio óptico, o incluso algunos microscopios de súper resolución, porque estas cosas son demasiado pequeñas", dijo Lew.
Con la tecnología de imágenes de alta dimensión desarrollada en el laboratorio de Lew en los últimos años, pueden ver las diferencias.
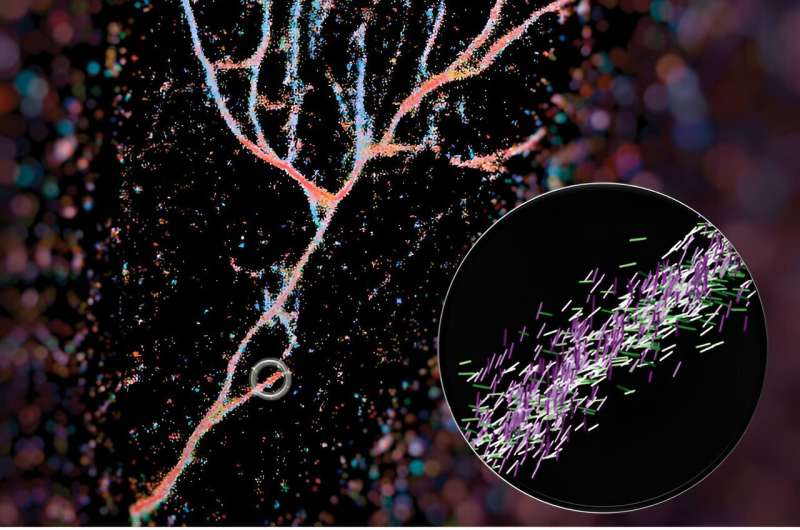
Un microscopio de fluorescencia típico utiliza moléculas fluorescentes como bombillas para resaltar ciertos aspectos de un objetivo biológico. En el caso de este trabajo utilizaron una de esas sondas, la roja del Nilo, como sensor de lo que había a su alrededor. A medida que el rojo del Nilo explora aleatoriamente su entorno y choca con las fibrillas, emite destellos de luz que pueden medir para determinar dónde está la sonda fluorescente y su orientación. A partir de esos datos, pueden reconstruir el panorama completo de las fibrillas diseñadas que se acumulan de manera muy diferente a las naturales, como la beta amiloide.
Su imagen de estos conjuntos de fibrillas apareció en la portada de ACS Nano. y fue elaborado por el primer autor Weiyan Zhou, quien codificó la imagen con colores según hacia dónde apuntaban los rojos del Nilo. La imagen resultante es un conjunto de péptidos que fluye de color rojo azulado y que parece el valle de un río.
Los investigadores planean continuar desarrollando técnicas como SMOLM para abrir nuevas vías de estudio de estructuras y procesos biológicos a nanoescala.
"Estamos viendo cosas que no se pueden ver con la tecnología existente", afirmó Lew.
Más información: Weiyan Zhou et al, Resolución de la estructura a nanoescala de autoensamblajes de péptidos de lámina β mediante microscopía de orientación y localización de una sola molécula, ACS Nano (2024). DOI:10.1021/acsnano.3c11771
Información de la revista: ACS Nano
Proporcionado por la Universidad de Washington en St. Louis