Fig. 1 Efecto del enfoque de integración. Crédito:Hisasi Tadakuma / Universidad de Osaka
La expresión genética es fundamental en la vida, donde cada célula activa y desactiva genes específicos. Por lo tanto, un dispositivo autónomo que pudiera controlar el encendido y apagado tendría un gran valor en la atención médica.
Los circuitos genéticos sintéticos son una tecnología para controlar la expresión génica y programar las células para que realicen las funciones deseadas. Por lo tanto, Aumentar la complejidad del circuito genético nos permitirá controlar el destino de las células con mayor precisión.
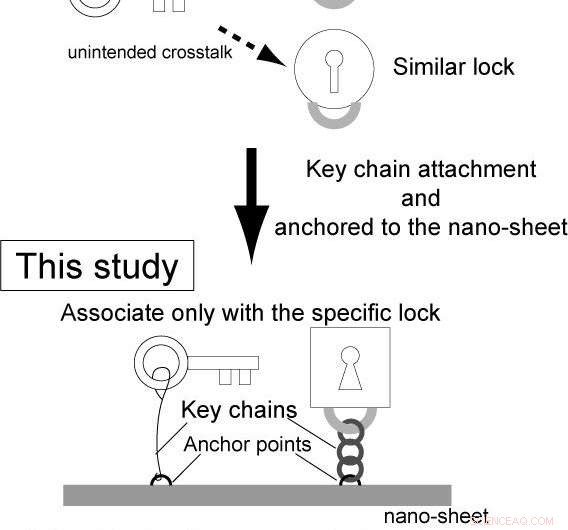
Sin embargo, la complejidad de los circuitos genéticos sigue siendo baja. Esto es porque, en sistemas convencionales de reacción-difusión, las enzimas y los sustratos se proporcionan por separado, y la unión no específica de las enzimas a los sustratos provoca una diafonía no intencionada entre los diferentes circuitos.
Investigadores dirigidos por la Universidad de Osaka, en un proyecto de investigación conjunto con la Universidad de Tokio, Universidad de Kyoto, y la Universidad de Waseda, construyó chips de lógica de genes integrados llamados "nanochips de genes". Usando factores integrados en los nanochips, Estos nanochips autónomos pueden activar y desactivar genes dentro de un solo chip, Previniendo la diafonía involuntaria.
Los investigadores mostraron las respuestas autónomas de los nanochips en células artificiales:detección ambiental, cálculo de información y salida de productos a nivel de un solo chip. Los resultados de su investigación se publicaron en Nanotecnología de la naturaleza .
La nanotecnología de ADN es un método versátil que se utiliza para construir estructuras personalizadas y controlar diseños moleculares precisos. Los investigadores utilizaron una hoja rectangular (90 nm de ancho, 60 nm de profundidad, 2 nm de altura), y enzima integrada, ARN polimerasa (RNAP, una enzima que sintetiza ARN a partir de una plantilla de ADN), y múltiples sustratos de genes diana.
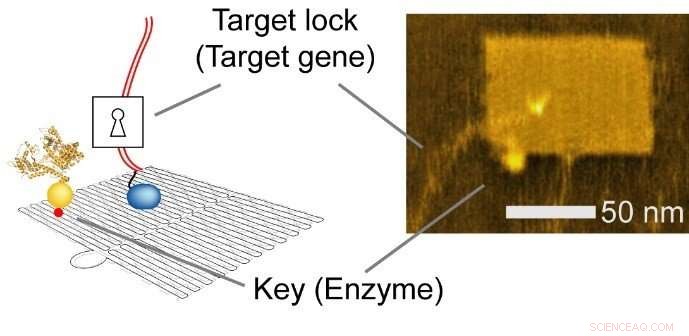
Fig.2 Nanochip integrado. Izquierda, Ilustración esquemática. Derecha, Imagen de microscopía de fuerza atómica (AFM). Crédito:Hisashi Tadakuma / Universidad de Osaka
La capacidad de nano-disposición de la nanotecnología del ADN permite al investigador diseñar racionalmente los niveles de expresión génica cambiando las distancias intermoleculares entre la enzima y los genes diana. afectando así la eficacia de la colisión y la reacción subsiguiente.
Los investigadores integraron aún más sensores. Idealmente, un sensor que sea capaz de detectar cualquier tipo de señal debería tener limitaciones de diseño mínimas. Sin embargo, Los métodos convencionales han sufrido varias limitaciones (por ejemplo, materiales). Esto es porque, en circuitos genéticos convencionales, el sensor es parte del sustrato de la enzima (p. ej., ADN en transcripción; consulte la Nota para obtener más detalles).
En cambio, en este estudio, la parte del sensor era independiente de la reacción enzimática. Por lo tanto, los investigadores pueden utilizar cualquier material sensor que cambie la distancia intermolecular efectiva en el reconocimiento de señales, permitiendo la construcción de varios sensores que responden a distintas señales (microARN, compuestos químicos, proteínas y luz). Es más, mediante la combinación e integración de sensores que responden a distintas señales, los investigadores han logrado foto-reprogramar los circuitos genéticos.
Finalmente, el nanochip permitió a los investigadores simplificar la construcción de un circuito genético que respondía a una célula artificial, una gota de agua en aceite, y podrían calcular su perfil de miARN, simplemente mezclando los chips ortogonales, expandiendo el poder del circuito genético.
El autor para correspondencia Hisashi Tadakuma dice:"Todos los factores necesarios para las reacciones de transcripción están en este nanochip integrado, tan sensorial ambiental, cálculo de información, y la salida del producto se puede completar a nivel de un solo chip. En el futuro cercano, Los nanochips autónomos serán útiles para mantener la célula en un estado saludable mediante el control de la expresión génica espacial y temporalmente. que encarnará el ideal del dicho "la prevención es la mejor cura". "
Idealmente, un sensor que sea capaz de detectar cualquier tipo de señal debería tener limitaciones de diseño mínimas. Sin embargo, Los métodos convencionales han sufrido varias limitaciones (por ejemplo, materiales). Esto es porque, en circuitos genéticos convencionales, la eficiencia de unión entre una enzima como RNAP (clave) y un gen objetivo (bloqueo de objetivo), específicamente una secuencia promotora en la molécula de ADN, está controlado por factores de transcripción (reguladores). Como los reguladores y las enzimas deben unirse al sensor (región del operador) cerca del bloqueo de destino, el material del sensor tiene que ser un sustrato de los reguladores y enzimas (p. ej., ADN en transcripción), y el regulador debería ser una proteína de unión al ADN. Por lo tanto, tanto el regulador (señal) como el sensor tienen limitaciones de material.
Sin embargo, en este estudio, la frecuencia de unión y la reacción subsiguiente están controladas por (1) la distancia intermolecular entre una enzima y un gen diana, y (2) las características del llavero (por ejemplo, rigidez, largo). Por tanto, la parte del sensor es independiente de la reacción enzimática, y el sensor y los reguladores no tienen limitaciones materiales, permitiendo que los distintos sensores respondan a distintas señales (compuestos químicos, proteínas y luz).