Gráficamente abstracto. Crédito:DOI:10.1038/s41565-021-00976-3
El profesor Kevin Braeckmans de la Universidad de Gante centró los últimos 10 años en un método para la ingeniería segura de células terapéuticas con nanofibras fototérmicas. Hoy, Nanotecnología de la Naturaleza da una idea de cómo se desarrollaron estas nanofibras fototérmicas biocompatibles y cómo, tras la irradiación con láser, las células que entran en contacto con esas nanofibras se permeabilizan y se pueden transfectar con una variedad de moléculas efectoras, incluidos los complejos de ribonucleoproteína CRISPR/Cas9 y siRNA. El profesor Braeckmans y su equipo demostraron que las células, como las células madre embrionarias y las células T humanas, transfectadas con dichas nanofibras gozan de excelente salud y conservan su funcionalidad terapéutica.
Nueva base para las terapias basadas en células
Las terapias basadas en células constituyen una nueva forma de tratamiento en la que se inyectan células genéticamente modificadas en el paciente para prevenir o tratar enfermedades. Un ejemplo bien conocido es el uso de las propias células inmunitarias de un paciente con cáncer que pueden aislarse, modificarse genéticamente y expandirse en un entorno de laboratorio, y reinfundirse en el paciente para atacar las células tumorales. La modificación genética de las células depende de las tecnologías de administración intracelular que a menudo luchan por obtener la eficiencia suficiente y tienen un impacto mínimo en la salud y el funcionamiento de la célula.
La fotoporación sensibilizada con nanopartículas es particularmente prometedora en este sentido, ya que normalmente proporciona alta eficiencia, alto rendimiento y baja toxicidad. Se basa en el uso de nanopartículas sensibles a la luz, como las nanopartículas de oro (NP), que pueden formar nanoburbujas explosivas tras la irradiación con láser pulsado. Esas pequeñas explosiones pueden inducir pequeños poros en las membranas celulares, lo que permite que las moléculas efectoras externas suplementadas en el medio celular entren en las células. Sin embargo, la traducción de la fotoporación sensibilizada con nanopartículas a aplicaciones clínicas se ve obstaculizada por el hecho de que las células han estado en contacto con nanopartículas (no degradables), lo que plantea problemas toxicológicos y regulatorios.
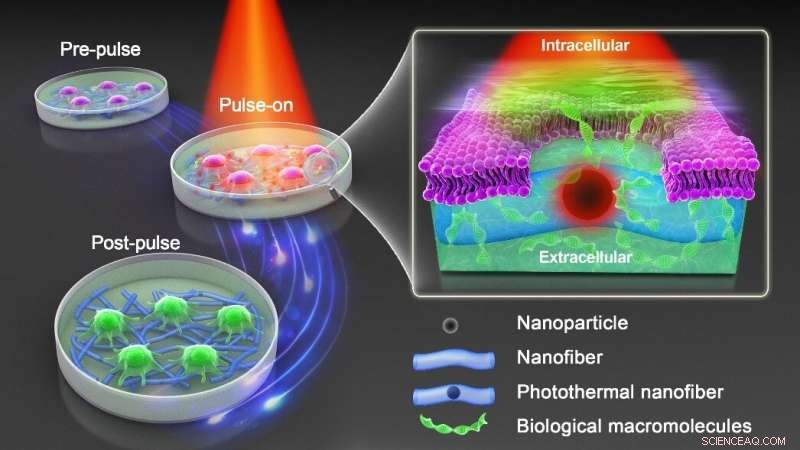
Por lo tanto, se necesita un nuevo enfoque que conserve la ventaja de la fotoporación sensibilizada con nanopartículas mientras evita el contacto directo de las nanopartículas y las células. Como se muestra en la figura anterior, el profesor Braeckmans y su equipo incrustaron nanopartículas fototérmicas de óxido de hierro (IONP) en nanofibras poliméricas biocompatibles que se produjeron mediante electrohilado. La policaprolactona (PCL) es un polímero biocompatible ampliamente utilizado en aplicaciones biomédicas, mientras que los IONP son rentables y tienen un amplio espectro de absorción de luz.
Muestran que tanto las células adherentes como las células en suspensión se pueden transfectar de manera segura y eficiente con una variedad de macromoléculas tras la irradiación con pulsos de láser de nanosegundos. Al realizar un análisis elemental a través de espectrometría de masas en tándem de plasma acoplado inductivamente (ICP-MS/MS), confirman que los IONP permanecen incrustados de manera segura en las nanofibras después de la irradiación con láser, de modo que las células tratadas están efectivamente libres de la exposición directa a las nanopartículas. Se realizaron simulaciones numéricas sobre la transferencia de calor desde los IONP integrados en fibra a las células cercanas para comprender mejor cómo la fluencia del pulso láser, la distribución del IONP y el estado de agregación influyen en la permeabilidad de la membrana celular.
Experimentalmente, el equipo demostró que la fotoporación con nanofibras fototérmicas podía entregar con éxito moléculas biológicas funcionales, incluidas las ribonucleoproteínas (RNP) siRNA o CRISP-Cas9, tanto a las células adherentes como en suspensión, incluidas las células madre embrionarias humanas (hESC) y las células T humanas primarias. Como punto de referencia se realizó una comparación con electroporación de última generación. Mientras que las células sometidas a electroporación sufrieron cambios en su fenotipo y funcionalidad, este no fue el caso de las células fotoporadas que mantuvieron su capacidad de proliferar y, en el caso de las células CAR-T, de destruir las células tumorales. Por último, se utilizó la fotoporación con PEN para transfectar células CAR-T con siRNA dirigido al receptor PD1, un conocido inhibidor del punto de control inmunitario. Se confirmó que las células tratadas con siPD1 tenían una mayor capacidad de eliminación de tumores in vivo.
Juntos, muestran que la fotoporación con nanofibras fototérmicas permite la administración intracelular eficiente y segura de una amplia gama de moléculas efectoras en una variedad de tipos de células sin contacto con nanopartículas fototérmicas potencialmente tóxicas. "Creemos que este es un paso importante hacia el uso de la fotoporación para la producción segura y eficiente de terapias con células modificadas genéticamente", dice el profesor Braeckmans. Los nanotubos de óxido de titanio facilitan la fotoporación asistida por láser de bajo costo