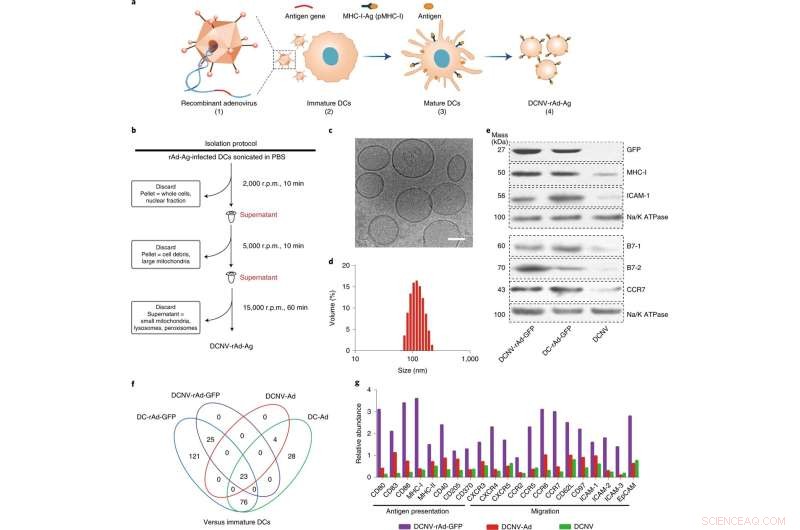
Generación y caracterización de DCNV-rAd-Ag. a, Generación de DCNV derivados de células dendríticas maduras infectadas con adenovirus. (1) Los genes del antígeno específico de tumor se diseñaron genéticamente en el vector de adenovirus. (2) El adenovirus recombinante infectó las células DC2.4 inmaduras para expresar el antígeno modificado en la superficie celular y estimularlo. (3) Diferenciación, maduración y presentación de antígenos. (4) Recolección de la membrana celular madura inducida y preparación de DCNV-rAd-Ag. b, Ilustración esquemática de la generación de DCNV-rAd-Ag. c, d, la microscopía crioelectrónica (c) y los análisis dinámicos de dispersión de luz (d) mostraron DCNV-rAd-Ag uniforme (diámetro promedio de aproximadamente 108 nm, índice de polidispersión =0,14) con una morfología similar a una vesícula. Barra de escala, 50 nm. e, la transferencia Western en proteínas de membrana de DCNV-rAd-GFP demuestra un contenido de proteína similar en la superficie en comparación con el de las células parentales. Los paneles c–e muestran resultados representativos de dos experimentos independientes con resultados similares. f, Comparación de proteínas relacionadas con la respuesta inmune reguladas al alza en NV y DC. g, la abundancia relativa de presentación de antígenos y proteínas relacionadas con la migración en DCNV-rAd-GFP. rpm, revoluciones por minuto. CCR, receptor de quimioquinas CC; CXCR, receptor de quimiocinas C-X-C; EpCAM, molécula de adhesión celular epitelial; ICAM 1, molécula de adhesión intercelular 1; pMHC-I, complejo principal de histocompatibilidad de péptidos clase I. Crédito:Nature Nanotechnology (2022). DOI:10.1038/s41565-022-01098-0
A medida que las personas de todo el mundo esperan una mayor esperanza de vida, los cánceres malignos continúan representando una amenaza para la salud humana. La exploración y desarrollo de la inmunoterapia tiene como objetivo buscar nuevos avances para el tratamiento de tumores sólidos.
El establecimiento exitoso de la inmunidad antitumoral requiere la activación, expansión y diferenciación de linfocitos específicos de antígeno. Este proceso depende en gran medida de interacciones específicas entre varias células T y células presentadoras de antígenos (APC) en el cuerpo. Sin embargo, las vacunas tumorales existentes, como las vacunas de neoantígenos y varias vacunas de vectores, dependen todas de interacciones aleatorias con APC en el cuerpo. Además, las interacciones inapropiadas pueden provocar el silenciamiento de otras respuestas inmunitarias.
Aunque se ha demostrado que la inmunoterapia basada en puntos de control inmunitarios tiene un gran potencial, solo una pequeña proporción de pacientes responde completamente a esta terapia, y es necesario explorar más a fondo los mecanismos moleculares relevantes. Sin embargo, este método de entrega es complejo e ineficiente.
En un avance revolucionario, un equipo de científicos dirigido por el profesor Chen Xiaoyuan, presidente de Narat Muzayyin, de la Facultad de medicina NUS Yong Loo Lin, y el profesor Liu Gang, de la Universidad de Xiamen, han formulado una nueva vacuna que mostró una alta eficacia en el tratamiento de tumores sólidos, logrando eliminación completa de tumores sólidos e inducción de una memoria inmune de larga duración. Esto previene la recaída del crecimiento tumoral que presentó originalmente el paciente y proporciona inmunidad contra tipos de tumores similares. Esto se comprobó mediante la aplicación de esta vacuna en modelos de tumores de melanoma. Sus resultados se publican en Nature Nanotechnology .
El equipo pudo diseñar una membrana de células dendríticas (un tipo de APC) que se utilizó para estimular naturalmente el sistema inmunitario y activar la inmunidad antitumoral multidimensional. Esto se hizo a través de una plataforma de vacuna de nanovesículas de reversión de inmunosupresión y autopresentación de antígenos, lo que llevó al equipo a acuñar su apodo, ASPIRE.
El sistema de vacunas ASPIRE puede provocar rápidamente respuestas inmunitarias específicas de antígeno apropiadas de una manera que los métodos de vacunas tradicionales no pueden. Este modo de presentación del antígeno mejora en gran medida la eficacia de la activación inmunitaria, lo que facilita la alta eficacia de esta nueva vacuna en relación con otras vacunas actualmente disponibles. Además, la vacuna también puede activar tanto las células T no expuestas previamente como las células T agotadas, lo que facilita las capacidades inmunitarias antitumorales superiores de ASPIRE.
"Estamos entusiasmados con el potencial de esta tecnología de plataforma para una mayor aplicación en otras enfermedades, como la infección viral crónica, en la que el agotamiento de las células T a menudo ocurre durante la infección y evita el control viral óptimo", dijo el profesor Chen. "A continuación, el equipo espera establecer un procedimiento operativo estándar para la síntesis a escala de la vacuna, con un control de calidad adecuado de las vesículas de membrana, para la traducción clínica", agregó.
Hablando de forma independiente sobre el estudio, el profesor Chng Wee Joo, consultor sénior de la División de Hematología del Departamento de Hematología-Oncología del Instituto Nacional del Cáncer de la Universidad de Singapur y especialista en mieloma, dijo:"El campo de la inmunoterapia contra el cáncer ofrece una gran esperanza para el cáncer. pacientes. Sin embargo, existen algunas deficiencias con las tecnologías actuales. La presente innovación del profesor Chen y sus colegas superó algunas de estas deficiencias y mejoró la eficacia y
sostenibilidad de la respuesta inmunitaria a estos tratamientos. Esto proporcionará una importante avance que tendrá un impacto importante en los pacientes". Nanotecnología de vacunas emergentes