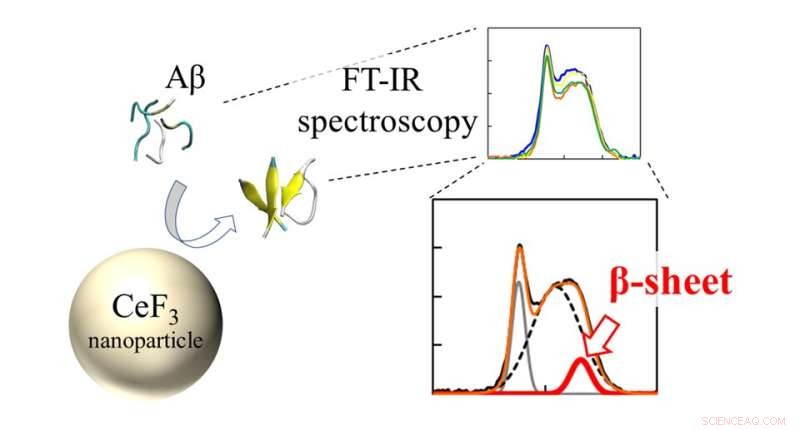
Los espectros infrarrojos (FT-IR) y la relación de hoja β de los péptidos Aβ interactuaron con las NP de CeF3. El efecto de las nanopartículas de CeF3 sobre la estructura de la proteína beta amiloide se mide directamente con espectroscopia FT-IR. La formación de la estructura secundaria aparece como una característica en el espectro IR. Crédito:Masakazu Umezawa/Universidad de Ciencias de Tokio, Tipo de licencia:CC BY 4.0
La función y la actividad de las proteínas están determinadas tanto por su ensamblaje como por su estructura secundaria. Las anomalías relacionadas con la agregación de proteínas o la estructura secundaria pueden conducir a enfermedades neurodegenerativas. En un nuevo estudio, un equipo de investigación internacional revela cómo las nanopartículas de fluoruro, materiales utilizados en imágenes in vivo, afectan el ensamblaje y la estructura de la proteína β amiloide. Sus resultados presentan un paso hacia un mejor tratamiento y prevención de trastornos neurológicos como la enfermedad de Alzheimer.
El autoensamblaje, o la asociación de unidades individuales de un material en estructuras o patrones ordenados, es un fenómeno de gran interés para la investigación de los científicos de materiales. Un ejemplo destacado de autoensamblaje proviene del autoensamblaje de proteínas en sistemas biológicos. La función y la actividad de las proteínas se rigen por su estado de ensamblaje. Además, la "estructura secundaria" de la proteína, caracterizada por plegarse en estructuras, como una hoja β, también juega un papel. De hecho, las anomalías en las estructuras secundarias de las proteínas o en su ensamblaje pueden dar lugar a diversas enfermedades neurodegenerativas, incluida la enfermedad de Alzheimer.
Las nanopartículas (NP) ofrecen una ruta prometedora para el tratamiento y la prevención de tales enfermedades al permitir una administración de fármacos controlada y dirigida. Además, las NP inorgánicas, como las NP de fluoruro, se utilizan en aplicaciones de imágenes cerebrales. En comparación con las NP orgánicas, las NP inorgánicas se consideran mejores candidatas para desarrollar materiales altamente funcionales. Pero, hay mucha preocupación con respecto a su biotoxicidad. Si bien se han estudiado sus interacciones con bioproteínas, el mecanismo subyacente a estas interacciones no se comprende bien.
Un equipo internacional de científicos de la Universidad de Ciencias de Tokio (TUS) en Japón y la Universidad de Nazarbayev en Kazajstán ahora ha abordado este problema. En su estudio, que estuvo disponible en línea el 2 de junio de 2022 y se publicó en la revista ACS Applied Bio Materials el 20 de junio de 2022, el equipo investigó una sección del péptido β amiloide (una proteína que se encuentra en las placas que se forman en el cerebro de los pacientes con enfermedad de Alzheimer) en una solución con cerámica de fluoruro (CeF3 ) NP. El estudio fue dirigido por el Profesor Asociado Junior Masakazu Umezawa e incluyó contribuciones del Sr. Naoya Sakaguchi de TUS y los Profesores Asistentes Mehdi Amouei Torkmahalleh y Dhawal Shah de la Universidad de Nazarbayev.
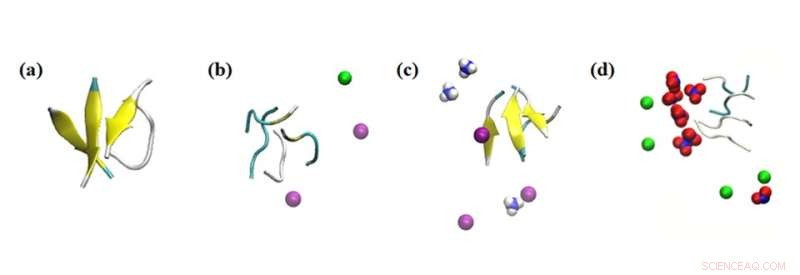
Instantáneas de simulación de las interacciones del agregado peptídico con varios iones. Resultados de la simulación del efecto de los iones dentro de 0,1 nm sobre los péptidos en los sistemas en estudio:(a) sin sal, (b) NaCl 0,15 M, (c) NH4Cl 0,15 M y (d) NaNO3 0,15 M. Coloración:hoja beta =amarillo; Na+ =verde; NH4+ =azul y blanco; Cl- =púrpura; y NO3− =azul y rojo. Crédito:Masakazu Umezawa/Universidad de Ciencias de Tokio, Tipo de licencia:CC BY 4.0
El equipo utilizó una técnica llamada "espectroscopia infrarroja transformada de Fourier" (FTIR) para monitorear directamente el efecto de la superficie NP en los enlaces peptídicos. "Descubrimos que cerca de la superficie de las nanopartículas, es más probable que los péptidos formen hojas β. Esto se debe a la hidrofobicidad. Las partes del péptido que son repelidas por la solución de agua se adhieren a las nanopartículas y forman agregados más fácilmente". explica el Dr. Umezawa.
Además, el equipo investigó el efecto de otros iones circundantes en la solución. "Lo que encontramos fue muy sorprendente. Incluso sin las nanopartículas, el entorno afectó la tasa de formación de estructuras secundarias", dice el Dr. Umezawa. "Este efecto, resultante de una combinación de interacción electrostática y enlaces de hidrógeno, se exageró al agregar nanopartículas. Con una selección cuidadosa de iones y nanopartículas, la formación de láminas β puede suprimirse o promoverse. Esto implica que el proceso puede controlarse y diseñarse para erradicar los efectos adversos".
Los resultados experimentales se complementaron con simulaciones de dinámica molecular realizadas por el equipo de la Universidad Nazarbayev. Esto, a su vez, ayudó a diseñar y guiar los experimentos, además de brindar información sobre los resultados.
Con esta comprensión más profunda de la interacción entre proteínas y NP, el estudio allana el camino para controlar los procesos de plegamiento de proteínas. Con dicho control, se podría eliminar cualquier deformación de la proteína y se podrían promover interacciones positivas y cambios estructurales. Esto podría conducir a un mejor protocolo de prevención y tratamiento para la enfermedad de Alzheimer y, eventualmente, a una mejor calidad de vida para los adultos mayores. Decodificación de la dinámica de ensamblaje de proteínas con agujas de proteínas artificiales