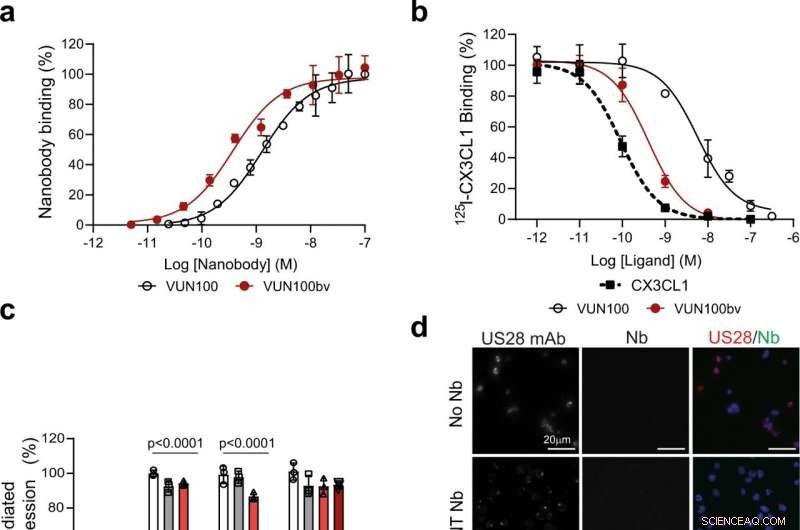
Fig. 1:VUN100bv se une e inhibe la señalización de US28. a Unión ELISA de VUN100 monovalente y VUN100bv bivalente a extractos de membrana de células HEK293T que expresan US28. Figura representativa de tres experimentos independientes. B Desplazamiento de 125I-CX3CL1 de membranas que expresan US28 por ligando no marcado o los nanocuerpos VUN100 y VUN100bv. Figura representativa de tres experimentos independientes. C Efecto de nanocuerpos sobre la activación de NFAT (factor nuclear de células T activadas) mediada por US28. Células HEK293T que expresan solo informador de NFAT-luciferasa (Mock) o informador de NFAT-luciferasa junto con el receptor de tipo salvaje US28 (WT), Mutante US28 Y16F (Y16F), Mutante US28 ΔN (2-22) (ΔN (2-22)) o mutante US28 R129A (R129A). Las células no se trataron (untr) o se trataron con un nanocuerpo no dirigido (NT Nb), VUN100, o VUN100bv durante 24 h antes de la medición de luminiscencia. Los datos se normalizaron a las muestras de WT sin tratar. Figura representativa de tres experimentos independientes. D Microscopía de inmunofluorescencia de nanocuerpos que se unen a células THP-1 que expresan US28. Se detectó US28 usando un anticuerpo policlonal de conejo anti-US28 (mAb US28). Las células se incubaron sin nanocuerpo (No Nb), un NT Nb, VUN100, o VUN100bv. El nanocuerpo unido se detectó utilizando la etiqueta Myc presente en los nanocuerpos y un anticuerpo anti-Myc (Nb). Figura representativa de tres experimentos independientes. mi Detección de transferencia Western para los niveles totales de IFI16 de lisados de células transducidas simuladas de THP-1 no tratadas (THP-1 Mock) o células THP-1 que expresan US28 (THP-1 US28 WT). Las células THP-1 US28 WT no se trataron (Untr) o se trataron con NT Nb, VUN100, o VUN100bv durante 48 h. Se determinaron los niveles de proteína IFI16 y se normalizaron a los niveles de proteína actina. Los niveles de proteína IFI16 relativos se normalizaron a lisados de células simuladas de THP-1 sin tratar. n =3 experimentos independientes de tres réplicas biológicas independientes. Todos los datos se representan como media ± S.D. Para todos los datos, a excepción de la Fig. 1c, Los análisis estadísticos se realizaron utilizando una prueba t de dos colas no apareada. Para la figura 1c, La significación estadística se determinó mediante el método de Holm-Sidak (bilateral con alfa =0,05). Los datos de origen se proporcionan como un archivo de datos de origen. Crédito:DOI:10.1038 / s41467-021-24608-5
Los científicos han desarrollado un "nanocuerpo", un pequeño fragmento de un anticuerpo de llama, que es capaz de ahuyentar el citomegalovirus humano (HCMV) mientras se esconde del sistema inmunológico. Esto permite que las células inmunitarias busquen y destruyan este virus potencialmente mortal.
Se cree que alrededor de cuatro de cada cinco personas en el Reino Unido están infectadas con HCMV, y en los países en desarrollo esto puede llegar al 95%. Para la mayoría de la gente, el virus permanece inactivo, escondido dentro de los glóbulos blancos, donde puede permanecer inalterado y sin ser detectado durante décadas. Si el virus se reactiva en un individuo sano, generalmente no causa síntomas. Sin embargo, para las personas inmunodeprimidas, por ejemplo, receptores de trasplantes que necesitan tomar medicamentos inmunosupresores para prevenir el rechazo de órganos; la reactivación del HCMV puede ser devastadora.
En el presente, no existe una vacuna eficaz contra el HCMV, y los medicamentos antivirales a menudo resultan ineficaces o tienen efectos secundarios muy graves.
Ahora, en un estudio publicado en Comunicaciones de la naturaleza , Investigadores de la Vrije Universiteit Amsterdam en los Países Bajos y de la Universidad de Cambridge han encontrado una manera de expulsar al virus de su escondite utilizando un tipo especial de anticuerpo conocido como nanocuerpo.
Los nanocuerpos se identificaron por primera vez en los camellos y existen en todos los camélidos, una familia de animales que también incluye dromedarios, llamas y alpacas. Los anticuerpos humanos constan de dos cadenas de moléculas pesadas y dos ligeras, que juntos reconocen y se unen a marcadores en la superficie de una célula o virus conocidos como antígenos. Para esta clase especial de anticuerpos de camélidos, sin embargo, sólo un fragmento del anticuerpo, a menudo denominado anticuerpo de dominio único o nanocuerpo, es suficiente para reconocer adecuadamente los antígenos.
Dr. Timo De Groof de Vrije Universiteit Amsterdam, el primer autor conjunto del estudio, dijo:"Como sugiere el nombre, Los nanocuerpos son mucho más pequeños que los anticuerpos normales, lo que los hace perfectamente adecuados para tipos particulares de antígenos y relativamente fáciles de fabricar y ajustar. Es por eso que están siendo aclamados por tener el potencial de revolucionar las terapias con anticuerpos ".
El primer nanocuerpo ha sido aprobado e introducido en el mercado por la empresa biofarmacéutica Ablynx, mientras que otros nanocuerpos ya se encuentran en ensayos clínicos para enfermedades como la artritis reumatoide y ciertos cánceres. Ahora, el equipo de los Países Bajos y el Reino Unido ha desarrollado nanocuerpos que se dirigen a una proteína de virus específica (US28), uno de los pocos elementos detectables en la superficie de una célula infectada de forma latente por HCMV y uno de los principales impulsores de este estado latente.
El Dr. Ian Groves del Departamento de Medicina de la Universidad de Cambridge dijo:"Nuestro equipo ha demostrado que los nanocuerpos derivados de llamas tienen el potencial de burlar al citomegalovirus humano. Esto podría ser muy importante ya que el virus puede causar complicaciones potencialmente mortales en personas cuyo los sistemas inmunológicos no funcionan correctamente ".
En experimentos de laboratorio con sangre infectada con el virus, el equipo demostró que el nanocuerpo se une a la proteína US28 e interrumpe las señales establecidas a través de la proteína que ayudan a mantener el virus en su estado latente. Una vez que este control se rompe, las células inmunitarias locales son capaces de 'ver' que la célula está infectada, Permitir que las células inmunitarias del huésped cacen y eliminen el virus, purgando el reservorio latente y limpiando la sangre del virus.
Dra. Elizabeth Elder, primer autor conjunto, quien llevó a cabo su trabajo mientras estaba en la Universidad de Cambridge, dijo:"La belleza de este enfoque es que reactiva el virus lo suficiente para hacerlo visible para el sistema inmunológico, pero no lo suficiente para que haga lo que normalmente hace un virus:replicarse y propagarse. El virus se ve obligado a poner su cabeza por encima del parapeto donde luego puede ser eliminado por el sistema inmunológico ".
Profesora Martine Smit, también de la Vrije Universiteit Amsterdam, agregó:"Creemos que nuestro enfoque podría conducir a un nuevo tipo de tratamiento muy necesario para reducir, y potencialmente incluso prevenir, la infección por CMV en pacientes elegibles para trasplantes de órganos y células madre".