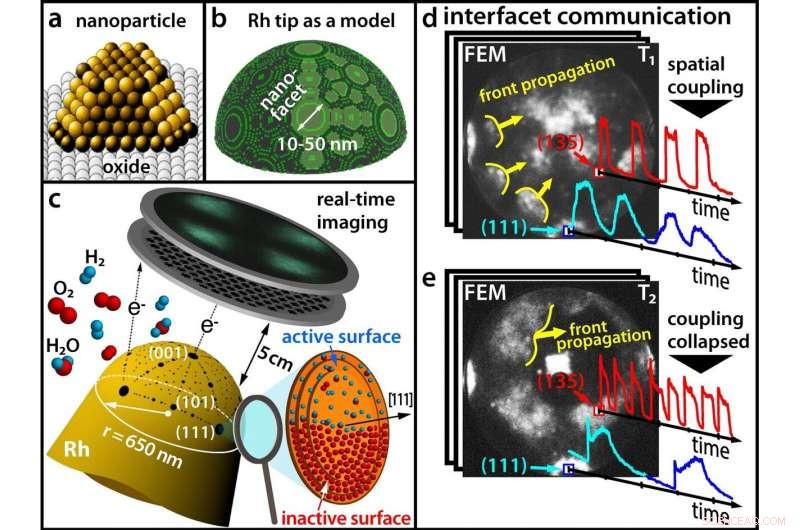
a) Cataylsts modernos compuestos de nanopartículas; (b) Una punta de rodio como modelo para una nanopartícula; (c) Seguimiento de una reacción química en tiempo real con un microscopio de emisión de campo (d) A bajas temperaturas, diferentes facetas oscilan en sincronía (e) A temperaturas más altas, la sincronicidad está rota. Crédito:Universidad Tecnológica de Viena
La mayoría de los productos químicos comerciales se producen mediante catalizadores. Generalmente, estos catalizadores consisten en diminutas nanopartículas metálicas que se colocan sobre un soporte oxídico. Similar a un diamante tallado, cuya superficie consta de facetas orientadas en diferentes direcciones, una nanopartícula catalítica también posee facetas cristalográficamente diferentes, y estas facetas pueden tener diferentes propiedades químicas.
Hasta ahora, estas diferencias a menudo no se han tenido en cuenta en la investigación de la catálisis porque es muy difícil obtener simultáneamente información sobre la reacción química en sí y sobre la estructura de la superficie del catalizador. En TU Wien (Viena), esto se ha logrado ahora mediante la combinación de diferentes métodos microscópicos:con la ayuda de la microscopía electrónica de campo y la microscopía de iones de campo, fue posible visualizar la oxidación del hidrógeno en una sola nanopartícula de rodio en tiempo real con una resolución nanométrica. Esto reveló efectos sorprendentes que habrá que tener en cuenta en la búsqueda de mejores catalizadores en el futuro. Los resultados ya se han presentado en la revista científica. Ciencias .
El ritmo de las reacciones químicas.
"En determinadas reacciones químicas, un catalizador puede alternar periódicamente entre un estado activo e inactivo, ", dice el profesor Günther Rupprechter del Instituto de Química de Materiales en TU Wien." Pueden ocurrir oscilaciones químicas autosostenidas entre los dos estados; el químico Gerhard Ertl recibió el Premio Nobel de Química por este descubrimiento en 2007 ".
Este también es el caso de las nanopartículas de rodio, que se utilizan como catalizador para la oxidación del hidrógeno, la base de cada pila de combustible. Bajo ciertas condiciones, las nanopartículas pueden oscilar entre un estado en el que las moléculas de oxígeno se disocian en la superficie de la partícula y un estado en el que se une el hidrógeno.
El oxígeno incorporado cambia el comportamiento de la superficie
"Cuando una partícula de rodio se expone a una atmósfera de oxígeno e hidrógeno, las moléculas de oxígeno se dividen en átomos individuales en la superficie del rodio. Estos átomos de oxígeno pueden luego migrar debajo de la capa superior de rodio y acumularse allí como oxígeno subsuperficial. "explica el profesor Yuri Suchorski, el primer autor del estudio.
A través de la interacción con el hidrógeno, estos átomos de oxígeno almacenados se pueden sacar de nuevo y reaccionar con los átomos de hidrógeno. Luego, nuevamente hay espacio para más átomos de oxígeno dentro de la partícula de rodio y el ciclo comienza de nuevo. "Este mecanismo de retroalimentación controla la frecuencia de las oscilaciones, "dice Yuri Suchorski.
Hasta ahora, Se pensaba que estas oscilaciones químicas siempre se producían sincrónicamente con el mismo ritmo en toda la nanopartícula. Después de todo, los procesos químicos en las diferentes facetas de la superficie de la nanopartícula están acoplados espacialmente, ya que los átomos de hidrógeno pueden migrar fácilmente de una faceta a las facetas adyacentes.
Sin embargo, Los resultados del grupo de investigación del profesor Günther Rupprechter y el profesor Yuri Suchorski muestran que las cosas son en realidad mucho más complejas:en determinadas condiciones, el acoplamiento espacial se eleva y las facetas adyacentes oscilan repentinamente con frecuencias significativamente diferentes, y en algunas regiones de la nanopartícula, estas "ondas químicas" oscilantes no se propagan en absoluto.
"Esto se puede explicar a escala atómica, "dice Yuri Suchorski." Bajo la influencia del oxígeno, las filas de átomos de rodio que sobresalen pueden emerger de una superficie lisa ”. Estas filas de átomos pueden actuar como una especie de“ rompe olas ”y obstaculizar la migración de átomos de hidrógeno de una faceta a otra:las facetas se desacoplan.
Si este es el caso, las facetas individuales pueden formar oscilaciones de diferentes frecuencias. "En diferentes facetas, los átomos de rodio están dispuestos de manera diferente en la superficie, "Dice Günther Rupprechter." Es por eso que la incorporación de oxígeno bajo las diferentes facetas de la partícula de rodio también avanza a diferentes velocidades, y así las oscilaciones con diferentes frecuencias resultan en facetas cristalográficamente diferentes ".
Una punta de hemisferio como modelo de nanopartículas
The key to unraveling this complex chemical behavior lays in using a fine rhodium tip as a model for a catalytic nanoparticle. An electric field is applied, and due to the quantum mechanical tunneling effect, electrons can leave the tip. These electrons are accelerated in the electric field and hit a screen, where a projection image of the tip is then created with a resolution of around 2 nanometers.
In contrast to scanning microscopies, where the surface sites are scanned one after the other, such parallel imaging visualizes all surface atoms simultaneously—otherwise it would not be possible to monitor the synchronization and desynchronization of the oscillations.
The new insights into the interaction of individual facets of a nanoparticle can now lead to more effective catalysts and provide deep atomic insights into mechanisms of non-linear reaction kinetics, pattern formation and spatial coupling.