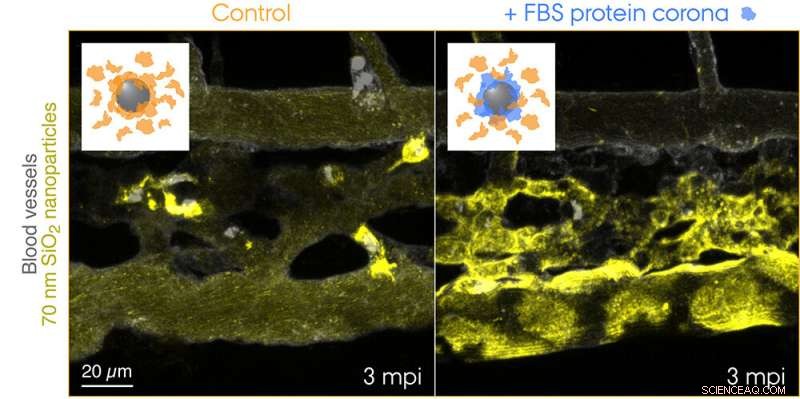
Se inyectaron nanopartículas de SiO2 de 70 nm marcadas con fluorescencia en el torrente sanguíneo de embriones de pez cebra transgénico de 3 días de edad y se obtuvieron imágenes en vivo 3 min después de la inyección. Los recuadros muestran esquemas para las dos condiciones probadas:nanopartículas de control con una corona de proteínas endógenas (naranja) y nanopartículas con una corona preformada de proteínas de suero bovino fetal (FBS) (azul) y proteínas endógenas adicionales. Los macrófagos capturan rápidamente las nanopartículas de control, mientras que las nanopartículas con una identidad biológica no propia son efectivamente secuestradas por células endoteliales depuradoras. Crédito:Yuya Hayashi. Adaptado de Mohammad-Beigi et al. (2020) ACS Nano. Copyright 2020 Sociedad Química Estadounidense
Una variedad de nanopartículas están diseñadas para la administración de medicamentos dirigida, pero, lamentablemente, solo una proporción muy pequeña de las nanopartículas inyectadas llega al sitio objetivo, como los tumores sólidos. La razón detrás de la baja eficiencia de focalización a menudo se considera una "caja negra" y, por lo tanto, se ha explorado poco durante muchos años.
Recientemente, un equipo de investigación internacional dirigido por Yuya Hayashi del Departamento de Biología Molecular y Genética (MBG), Universidad de Aarhus, demostró la belleza de los embriones de pez cebra en nano-bioimágenes que pueden visualizar interacciones dinámicas entre nanopartículas y células de interés en un organismo vivo (ver otro artículo "El pez cebra te permite ver el destino biológico de las nanopartículas in vivo").
Ahora, trabajando en equipo con investigadores del Centro Interdisciplinario de Nanociencia (iNANO), Yuya busca responder a misterios sin resolver en bionanociencia; el primero en la fila es el concepto de identidad biológica, lo que explica cómo las células reconocen las nanopartículas a través de una "corona" de proteínas que rodean cada partícula. Este concepto ha sido probado por primera vez en un organismo vivo mediante el uso de embriones de pez cebra que descubren lo que sucede con las nanopartículas inyectadas en la sangre.
¿Amigo o enemigo? Cómo los sistemas biológicos reconocen las nanopartículas
"What the Cell Sees in Bionanocience" es una de las primeras publicaciones que ha definido cómo se forma una corona de proteínas alrededor de una nanopartícula y cómo tal corona de proteínas implica la necesidad de repensar la forma en que miramos las nanopartículas dentro de un medio biológico. De una extensa investigación en la última década, ahora entendemos que dos efectos opuestos contribuyen principalmente a la absorción de nanopartículas por las células. En general, la corona de proteínas evita que la superficie de la nanopartícula tenga interacciones físicas directas con la membrana celular. Sin embargo, ¿Qué pasa si la corona de proteínas presenta una señal que desencadena una interacción biológica específica con los receptores desplegados en la membrana celular? Eso es algo que la célula ve y, por tanto, confiere una identidad biológica a la nanopartícula.
Ahora, los investigadores de la Universidad de Aarhus han proporcionado la primera evidencia "visual" de la sorprendente contribución de la corona de proteínas a la eliminación de nanopartículas de la sangre que conllevó resultados adversos en el modelo de embrión de pez cebra. El equipo de investigación utilizó una fuente de proteínas no coincidente entre especies para la formación de la corona para crear una identidad biológica "no propia" y rastreó el viaje de las nanopartículas que viajan a través de la sangre hasta su destino final:los endolisosomas en la célula. Esto reveló una absorción y acidificación sorprendentemente rápidas de las nanopartículas por las células endoteliales depuradoras (equivalente funcional a las células endoteliales sinusoidales del hígado en los mamíferos) seguido de la activación proinflamatoria de los macrófagos (ver la película presentada en la página web del grupo de Yuya).
"Parece una idea loca inyectar nanopartículas con proteínas de otro animal, "dice Yuya, "pero por ejemplo, Las nanomedicinas inspiradas en biomoléculas se prueban en un modelo de ratón sin preocupaciones particulares por la combinación de especies no coincidentes. O bien, algunas personas inteligentes humanizan al ratón para solucionar el problema de compatibilidad de especies. De hecho, incluso a nivel de cultivo celular, las nanopartículas se siguen probando de forma rutinaria siguiendo la tradición de utilizar suplementos de suero derivado de vacas sabiendo que las interacciones entre nanopartículas y proteínas son un factor clave de la absorción celular ".
"Lo que hace que este tipo de experimentos sea un desafío es, "añade el primer autor Hossein Mohammad-Beigi, "para retener al máximo la corona proteica original en un organismo vivo. Si la corona preformada se intercambia rápidamente por proteínas sanguíneas endógenas, la hipótesis probada deja de ser válida. Hemos realizado bastantes esfuerzos para caracterizar la corona de proteínas para garantizar que las nanopartículas preserven la identidad biológica no propia ".
Ver para creer:el modelo de pez cebra puede ofrecer lo que los modelos de roedores no pueden
La mayor ventaja del modelo de pez cebra es su poder en imágenes multicolores en tiempo real, mediante el cual se pueden obtener imágenes de múltiples combinaciones de trazadores de fluorescencia y proteínas informadoras en una configuración simple con alta resolución espacio-temporal. Esto brinda una nueva oportunidad que se encuentra entre sistemas de cultivo celular menos realistas y experimentos con roedores más desafiantes, como la microscopía intravital.
"Utilizando cultivos celulares, Hemos aprendido bastante sobre cómo las células reconocen las nanopartículas en lugar de agregados dinámicos de proteínas, pero nunca se probó en una situación más realista. "Explica Yuya." Con el establecimiento del modelo de pez cebra, finalmente hemos adquirido un medio para explorar más a fondo esta cuestión en un organismo vivo. Fue un enfoque simple con un escenario extremo probado en un sistema muy complejo, pero creo que ahora estamos un paso más cerca de comprender lo que realmente puede significar la corona de proteínas para las nanopartículas. En un entorno rico en proteínas, las nanopartículas pueden llevar una máscara que les confiere una identidad biológica, y su no-egoísmo puede convertirlos en enemigos. ¿Qué define el grado de no egoísmo? Bien, es la próxima gran pregunta que tenemos que abordar ".