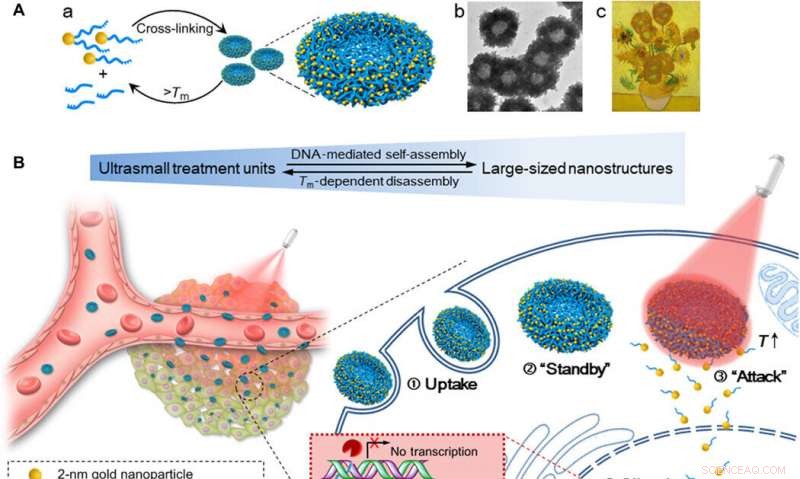
Esquema de nano girasoles de ADN de oro autoensamblados para una mayor cantidad de captación celular, eficacia del silenciamiento génico sintonizable, y efecto de inhibición tumoral controlada por irradiación NIR. (A) (a) Montaje y desmontaje de la nanoestructura de gran tamaño (nanosgirasol de ADN de oro de 200 nm) de / a nanopartículas ultrapequeñas (NP de Au-POY2T de 2 nm). (b) Imagen TEM representativa de los nanosgirasol. (c) Obra maestra:Girasoles (Vincent van Gogh, 1889). (B) Izquierda:Retención de tumores in vivo y penetración de nanogirasoles transformables. Derecha:captación celular mejorada y proceso de silenciamiento de oncogén controlado de los nanosgirasol in vitro. ① Nano girasoles de gran tamaño fueron captados por una celda MCF-7. ② Los nanogirasoles en espera en el citoplasma celular. ③ Tras la irradiación NIR, Las nanoestructuras de oro-ADN de gran tamaño se disocian y liberan pequeñas unidades (NP de Au-POY2T de 2 nm) para atacar el núcleo celular. ④ La secuencia de silenciamiento POY2T se unirá al promotor P2 del oncogén c-myc y regulará negativamente la expresión de c-myc de las células MCF-7, que puede ser controlado (ON / OFF) y regulado (Bajo / Medio / Alto) por la irradiación NIR. Crédito: Avances de la ciencia , doi:10.1126 / sciadv.aaw6264
El desarrollo de un sistema de administración eficiente para terapias basadas en interferencias génicas mejoradas y controladas es un desafío existente en biología molecular. El campo en avance de la nanotecnología puede proporcionar una estrategia interdisciplinaria para facilitar la entrega de ácidos nucleicos. En un nuevo informe, Shuaidong Huo y colegas de los departamentos interdisciplinarios de Nanociencia, Materiales interactivos, Investigación química y de polímeros en China, Alemania y Estados Unidos utilizaron secuencias de oligonucleótidos formadores de triplex acopladas a su cadena complementaria para mediar en el autoensamblaje de nanopartículas de oro ultrapequeñas.
Las nanoestructuras similares a girasoles resultantes mostraron una fuerte absorción del infrarrojo cercano (NIR) y capacidad para la conversión fototérmica. Cuando los científicos irradiaron las estructuras con NIR, las nanoestructuras más grandes se desmontaron para generar nanopartículas ultrapequeñas modificadas con la secuencia del oncogén c-Myc para dirigirse directamente al núcleo de la célula cancerosa. Huo y col. controló el silenciamiento génico mediante el control sinérgico del tiempo de preincubación de las células con nanopartículas junto con el autoensamblaje de la nanoestructura (in vitro e in vivo) y el marco de tiempo de la irradiación NIR. El estudio proporcionó un nuevo paradigma para construir nanoportadores eficientes y personalizados para aplicaciones de interferencia genética y entrega de genes terapéuticos.
La terapia genética tiene un gran potencial para tratar una variedad de enfermedades y complicaciones, incluida la infertilidad, VIH y cáncer. La terapia génica exitosa para aliviar los síntomas de la enfermedad depende de un vehículo o vector de administración de genes eficiente. Durante el proceso, el portador del gen debe cruzar muchas barreras biológicas y membranas celulares mientras escapa al atrapamiento endosómico y la degradación basada en nucleasas. En comparación con las estrategias de entrega basadas en virus, Los enfoques de entrega de genes no virales enfrentan muchos desafíos durante el proceso de carga y liberación de ADN / ARN, entrega dirigida y captación intracelular, incluida la incompatibilidad relativa a las respuestas inmunitarias in vivo.
Se están realizando enérgicos esfuerzos en nanotecnología para diseñar vehículos estables y eficientes para la transferencia de genes a las células cancerosas. Debido a sus propiedades fisicoquímicas únicas, han surgido varios nanomateriales para la entrega de genes. Entre ellos, Las nanopartículas de oro (NP de Au) con tamaño y propiedades de superficie específicas pueden superar obstáculos in vivo para convertirse en uno de los sistemas portadores de genes más estudiados. Sin embargo, estas estrategias han encontrado una variedad de deficiencias y, por lo tanto, es importante establecer sistemas de administración eficientes o terapias génicas mejoradas y controladas.
Autoensamblaje y prueba de nanoestructuras similares a girasoles
En el presente trabajo, Huo y col. se inspiraron en la capacidad de la naturaleza para hibridar el ADN mediante la ingeniería de ADN mediado, nanoestructuras de ADN de oro autoensambladas (aproximadamente 200 nm). El diseño similar a un girasol mostró una fuerte absorción NIR y propiedades de conversión fototérmica. Tras la irradiación NIR, las estructuras desmontadas para liberar nanopartículas de oro ultrapequeñas (2 nm, Au NPs) con potencial para el silenciamiento de oncogenes, permeabilidad mejorada de células y núcleos y eficiencia de transfección mejorada. Los científicos controlaron sinérgicamente las interacciones entre células y nanomateriales en función del tiempo de preincubación en el laboratorio. seguido del tiempo de circulación in vivo y la cronología de la irradiación. Los experimentos facilitaron una mayor captación celular, eficacia del silenciamiento génico sintonizable e inhibición controlada de tumores. Los nano girasoles transformables proporcionaron un modelo excelente para diseñar nanovehículos para la administración de fármacos con gran potencial en biomedicina.
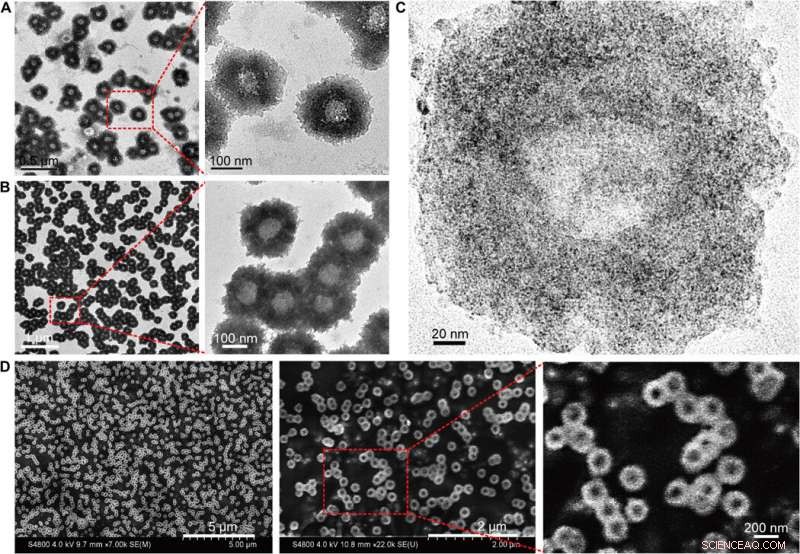
Caracterización morfológica de las nanoestructuras autoensambladas (nanogirasoles). (A) Imágenes TEM (200 kV) de los nanogirasoles con detalles estructurales agrandados. (B) Imágenes Bio-TEM (80 kV) con detalles estructurales de polímero agrandados. (C) Imágenes TEM de alta resolución (200 kV) que muestran la distribución de NP ultrapequeñas en la nanoestructura autoensamblada. (D) Imágenes SEM con topografía de superficie ampliada de los nanosgirasol. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
Huo y col. Primero sintetizó las NP de Au de dos nanómetros recubiertas con tiopronina y las modificó con oligonucleótidos de tiol (SH-POY2T) utilizando un método establecido de intercambio de ligandos. El oligonucleótido POY2T de 23 nucleótidos (nt) se unió al promotor P2 del oncogén c-myc para formar una estructura triple y regular negativamente la expresión oncogénica de c-myc. En paralelo, diseñaron y sintetizaron otra secuencia monocatenaria conocida como CA para hibridar de forma complementaria con la cola de la secuencia POY2T y bloquear su unión al oncogén c-myc. En la terminación, la nanoestructura autoensamblada en estructuras parecidas a un girasol. El equipo investigó la nanoestructura (200 nm) utilizando microscopía electrónica de transmisión (TEM). Imágenes adicionales revelaron más detalles de los restos de ADN de la estructura del "girasol". Cuando los científicos de materiales utilizaron microscopía electrónica de barrido (SEM) para validar los resultados de TEM, observaron coherencia entre los métodos.
Investigaron los espectros de absorción UV-Vis de las NP de Au ultrapequeñas antes del autoensamblaje mediado por ADN. El monodisperso, Los NP individuales de Au-POY2T de dos nanómetros mostraron una fuerte absorción en la región NIR para generar calor bajo irradiación NIR. Huo y col. acreditó la fuerte absorbancia NIR observada para cerrar el espaciamiento entre partículas y la distribución espacial no uniforme de los NP individuales dentro de la nanoestructura más grande. Probaron la respuesta al calor de las nanoestructuras autoensambladas bajo irradiación NIR y observaron el punto de fusión de las secuencias de ADN complementarias (POY2T y CA) en aproximadamente 41 grados C, disociar la mitad de la estructura dúplex entre secuencias de ADN complementarias. Huo y col. seleccionó 10 minutos como el tiempo óptimo para la irradiación NIR en el estudio.
Estudio de propiedades fototérmicas y comportamiento de desmontaje de las nanoestructuras autoensambladas. (A) Espectros de absorción visible de NP del tamaño de un núcleo de 2 nm y nanoestructuras autoensambladas de 200 nm. a.u., unidad de absorbancia. (B) Respuesta a la temperatura de nanoestructuras autoensambladas, tras la irradiación NIR, dispersado en agua y medio de cultivo celular. Valores medios ± DE, n =3. (C) Aumento de temperatura de nanoestructuras autoensambladas, tras la irradiación NIR, dispersado en agua y medio de cultivo celular. (D) Cambio de absorbancia máxima (767 nm) de NP del tamaño de núcleo de 2 nm y nanoestructuras autoensambladas de 200 nm tras la irradiación NIR. (E y F) Observación TEM del comportamiento de desmontaje de nanoestructuras autoensambladas de 200 nm antes (arriba) y después (abajo) de la irradiación NIR (808 nm, 10 minutos). (G) Diámetro hidrodinámico de (a) NPs de Au-POY2T monodispersas de 2 nm y cambio de tamaño de los nanosgirasol de 200 nm antes (b) y después (cyd) de la irradiación NIR durante diferentes períodos de tiempo (3 y 10 min). Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264 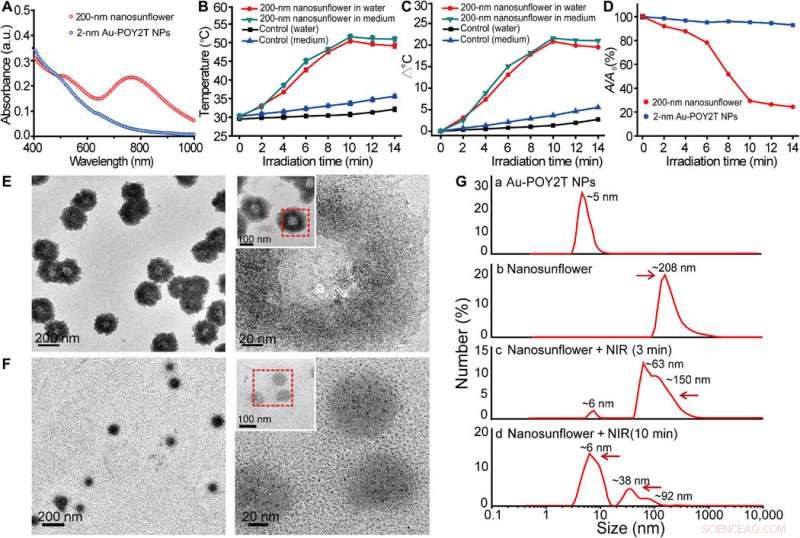
Los científicos plantearon la hipótesis de que las nanoestructuras autoensambladas se encogerían y desmontarían en NP de Au-POY2T ultrapequeñas individuales. Después de 10 minutos de irradiación NIR, la absorción máxima (767 nm) de nanoestructuras disminuyó notablemente al desmontar la estructura del girasol. Siguieron los experimentos antes y después de la irradiación NIR con observaciones TEM y utilizaron analizadores de tamaño de partículas para comprender el proceso de desmontaje y transformación de tamaño de las nanoestructuras de hasta seis nanómetros de tamaño y confirmaron la idoneidad óptima de la línea de tiempo de 10 minutos.
Huo y col. aplicó irradiación NIR a células MCF-7 tratadas con nanoestructuras de ADN de oro autoensambladas y probó su absorción celular in vitro como prueba de concepto. Determinaron la internalización celular de Au-POY2T (2 nm) a lo largo de diversos tiempos de incubación y cuantificaron su captación celular utilizando espectroscopía de masas de plasma acoplado inductivamente (ICP-MS) y métodos anteriores. Observaron una mayor internalización después de seis horas de incubación en comparación con los plazos de incubación de 24 horas. No observaron que los inhibidores de la endocitosis influyeran en la captación de NP de Au-POY2T, sugiriendo la participación de un camino alternativo como la fusión de membranas.
Comprender el comportamiento del silenciamiento génico de las nanoestructuras autoensambladas
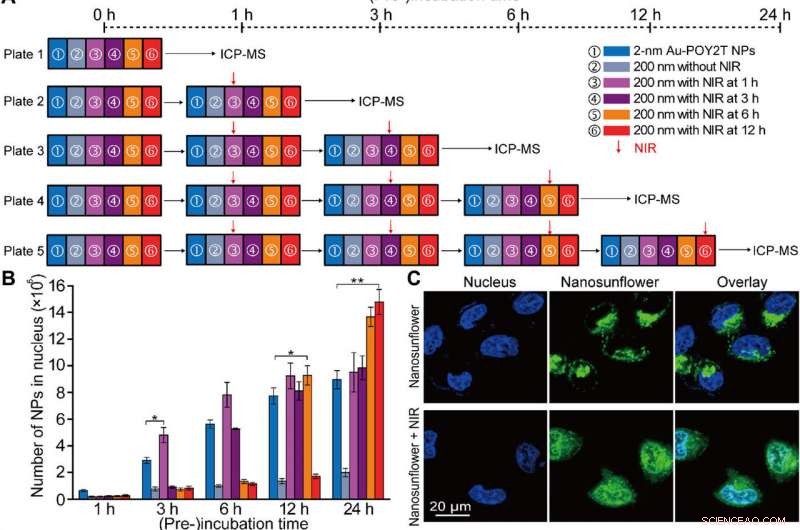
Estudio de localización de núcleos controlados y silenciamiento génico in vitro de las nanoestructuras autoensambladas. (A) Esquema de la configuración experimental de células in vitro para el estudio de regulación genética y localización del núcleo NP controlado. (B) Número de NP de Au-POY2T de 2 nm localizadas en el núcleo de la célula MCF-7 con tratamiento de ① NP de Au-POY2T de 2 nm individuales, ② nano girasoles de 200 nm, y nanogirasoles de 200 nm con irradiación NIR (10 min) después de diferentes tiempos de preincubación (③ 1, ④ 3, ⑤ 6, y ⑥ 12 horas). Valores medios ± DE, n =3. Las diferencias estadísticas se determinaron mediante la prueba t de Student de dos colas; * P <0,05 y ** P <0,01. (C) Observación confocal de la distribución de nano girasoles marcados con isotiocianato de fluoresceína (verde) antes (arriba) y después (abajo) de la irradiación NIR en células MCF-7. El núcleo se marcó con 4 ′, 6-diamidino-2-fenilindol (azul). (D) Imagen Bio-TEM de la localización de nanosgirasol de gran tamaño (arriba, flecha roja) en el citoplasma y distribución de NP pequeñas liberadas (abajo, flecha azul) en el citoplasma y el núcleo después de la irradiación NIR en células MCF-7. (E) Evaluación de la citotoxicidad de las células MCF-7 con tratamiento de nanogirasoles de 200 nm después de la irradiación NIR (después de un período de tiempo de preincubación:1, 3, 6, y 12 horas, respectivamente) en comparación con el control, NP de Au-TIOP de 2 nm, Secuencia POY2T, Secuencia CA, NP de Au-POY2T de 2 nm, Nanogirasoles de 200 nm sin irradiación NIR, y exposición NIR solamente. Todas las concentraciones de los tratamientos fueron iguales o iguales a 1 µM en la secuencia POY2T y se probaron después de un total de 24 horas de incubación. Valores medios ± DE, n =3. Las diferencias estadísticas se compararon con el grupo de tratamiento de ① NP de Au-POY2T de 2 nm individuales determinadas por la prueba t de Student de dos colas; * P <0,05 y ** P <0,01. (F) Nivel de ARNm de C-myc determinado por PCR en tiempo real después de diferentes tratamientos como se describe anteriormente. Valores medios ± DE, n =3. Las diferencias estadísticas se determinaron mediante la prueba t de Student de dos colas; ** P <0,01 y *** P <0,001. (G) Niveles de proteína C-myc determinados por Western blot y (H) histograma cuantitativo correspondiente después de diferentes tratamientos como se describió anteriormente. GAPDH, gliceraldehído fosfato deshidrogenasa. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
Después de una mayor absorción celular de nanoestructuras autoensambladas in vitro, El equipo de investigación investigó la distribución de nanopartículas dentro de los núcleos celulares utilizando estrategias de "espera" y "ataque" después de la activación de NIR. Para esto, extrajeron núcleos celulares después de la incubación, para el análisis ICP-MS después de la irradiación NIR durante diversos períodos de incubación (uno, Tres, seis y 12 horas). Señalaron que el período de preincubación afecta en gran medida la internalización de nanopartículas dentro del núcleo celular, y los investigadores regularon las NP de Au-POY2T en el núcleo celular en función del tiempo de preincubación y la irradiación NIR.
Huo y col. también investigó los efectos terapéuticos controlados de la irradiación NIR de los nanosgirasol utilizando pruebas de viabilidad celular; observaron que el silenciamiento de oncogenes aumentaba notablemente (80 por ciento) y mataba más células cancerosas. El equipo de investigación controló el impacto terapéutico de manera eficaz cambiando la línea de tiempo de preincubación e irradiación de manera eficiente. Los resultados respaldaron una capacidad superior de los nanogirasoles transformables para silenciar el oncogén y la oncoproteína c-myc. Los científicos controlaron el proceso de silenciamiento génico ajustando los plazos de preincubación antes de la irradiación NIR.
Control de la inhibición del crecimiento tumoral mediante nano girasoles autoensamblados
Para probar la eficacia antitumoral controlable de los nanosgirasol in vivo, los científicos primero investigaron su compatibilidad sanguínea para confirmar una buena biocompatibilidad sanguínea. Luego, el equipo de investigación estableció el modelo de tumor MCF-7 utilizando ratones desnudos BALB / c, permitió que los volúmenes tumorales alcanzaran los 50 mm 3 y dividió aleatoriamente a los animales en nueve grupos y los trató con 1000 µl de diferentes formulaciones de POY2T. Después de cada inyección, irradiaron los grupos de animales con láseres NIR durante 10 minutos para alcanzar una temperatura local superior a 41 grados C.
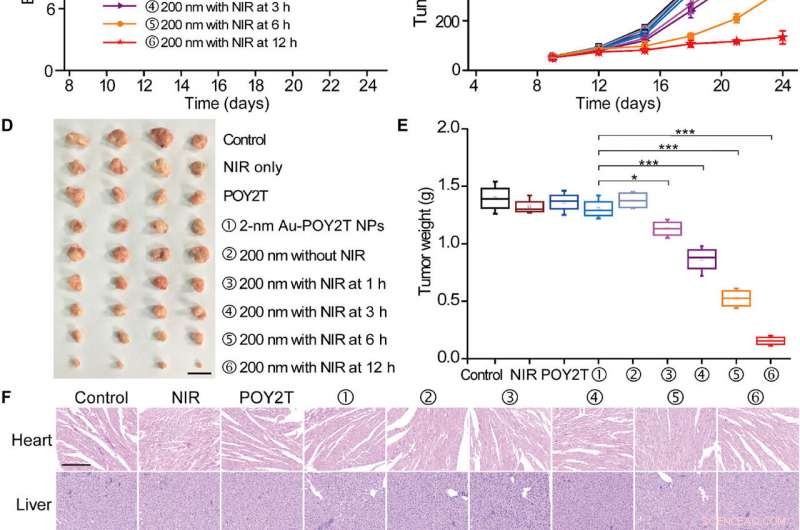
Estudio controlado de inhibición del crecimiento tumoral de las nanoestructuras autoensambladas. (A) El modelo de ratones desnudos BALB / c de tumor MCF-7 se estableció en el día 0. Una vez que los tumores estuvieron listos, los ratones se dividieron aleatoriamente en nueve grupos y se trataron con 100 μl de diversas formulaciones (equivalente a 10 μM en la secuencia POY2T; grupo ① con NP de Au-POY2T de 2 nm y grupos ②, ③, ④, ⑤, y ⑥ con nano girasoles de 200 nm) en los días 9, 12, y 15. En los grupos ③, ④, ⑤, y ⑥, los tumores se irradiaron con un láser NIR durante 10 min a 1, 3, 6, y 12 horas después de cada inyección intravenosa. Salina, Solo NIR, y POY2T se utilizaron como grupos de control. Los (B) pesos corporales y (C) los volúmenes tumorales se midieron cada 3 días. Barra de escala, 1 cm. Después de que los ratones fueron sacrificados el día 24, todos los tumores fueron (D) aislados y (E) ponderados, respectivamente. Valores medios ± DE, n =4. Las diferencias estadísticas se determinaron mediante la prueba t de Student de dos colas; * P <0,05, ** P <0,01, y *** P <0,001. (Crédito de la foto:Ningqiang Gong, Centro Nacional de Nanociencia y Tecnología, China.) (F) Imágenes de tinción con hematoxilina y eosina de órganos, incluido el corazón, hígado, bazo, pulmón, riñón, y tumor después de diferentes tratamientos. Barra de escala, 200 μm. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
De nota, Los ratones tratados con el grupo tratado con nanosgirasol e irradiados a las 12 horas mostraron los efectos antitumorales más significativos. lo que indica la entrega eficiente de unidades de silenciamiento génico en el sitio del tumor. Después de 24 días, Huo y col. sacrificó los animales, aislaron los tumores y los pesaron para demostrar la inhibición in vivo del crecimiento tumoral controlado por NIR basado en nanogiro. Basado en estudios histológicos, el equipo mostró que el tratamiento redujo significativamente el crecimiento tumoral y no afectó la morfología de otros órganos. Los resultados verificaron la eficacia terapéutica y la ausencia de efectos secundarios de los nanosgirasol y la terapia NIR.
De este modo, Shuaidong Huo y sus colegas diseñaron, nanoagentes desarrollados y optimizados para una terapia antitumoral eficaz. Diseñaron nanoestructuras similares a girasoles autoensambladas para actuar como portadores de múltiples partículas cargadas con muchas unidades terapéuticas ultrapequeñas. Tras la irradiación NIR, las nanoestructuras se disociaron para liberar enjambres de pequeñas NP para apuntar al núcleo celular. En ratones portadores de tumores, los grandes girasoles se dirigieron pasivamente al sitio del tumor seguido de irradiación NIR para transformar la composición genética del tumor y reducirla. El equipo de investigación tiene como objetivo mejorar la eficiencia de la transfección y proporcionar un modelo para el silenciamiento de genes controlable en sitios tumorales utilizando portadores de interferencia de genes transformables para teranósticos intrincados a nivel de una sola célula.
© 2019 Science X Network