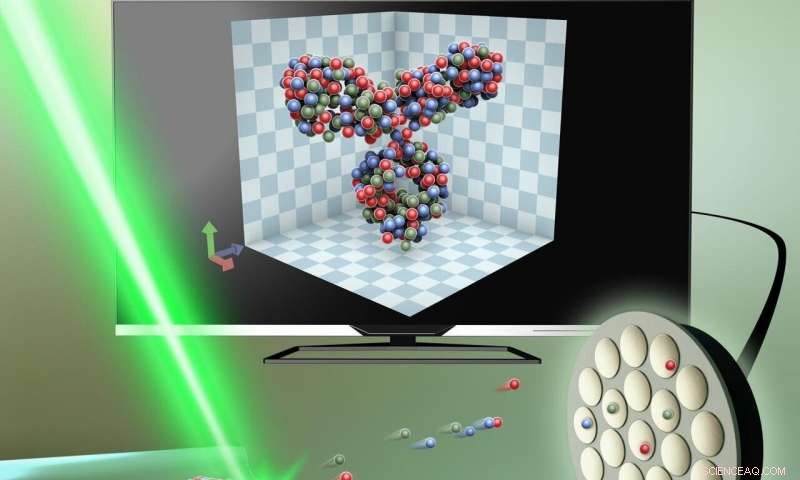
La proteína capturado en una pieza de vidrio extremadamente delgada, alrededor de 50 nanómetros de diámetro, se corta en rodajas, átomo por átomo, con la ayuda de un campo eléctrico. Luego se analiza mediante tomografía con sonda atómica, y la estructura 3D se recrea en una computadora. Crédito:Pequeño:Volumen 15, Número 24, Tomografía con sonda atómica para análisis estructural y químico 3D de proteínas individuales Gustav Sundell, Esteras Hulander, Astrid Pihl, Martin Andersson Copyright Wiley-VCH Verlag GmbH &Co. KGaA. Reproducido con permiso.
Investigadores de la Universidad Tecnológica de Chalmers, Suecia, han desarrollado un método único para estudiar proteínas que podría abrir nuevas puertas a la investigación médica. Mediante la captura de proteínas en una nanocápsula de vidrio, los investigadores han podido crear un modelo único de proteínas en entornos naturales. Los resultados se publican en la revista científica, Pequeña .
Las proteínas buscan objetivos y realizan muchas tareas diferentes necesarias para la supervivencia y las funciones de las células. Esto los hace interesantes para el desarrollo de nuevos medicamentos, en particular las proteínas que se encuentran en la membrana celular, y gobiernan qué moléculas pueden ingresar a la célula y cuáles no. Esto significa que comprender cómo funcionan estas proteínas es un desafío importante para desarrollar medicamentos más avanzados. Pero esto no es tarea fácil, estas proteínas son muy complejas. Hoy en día se utilizan varios métodos diferentes para obtener imágenes de proteínas, pero ningún método ofrece una solución completa al desafío de estudiar proteínas de membrana individuales en su entorno natural.
Un grupo de investigación de la Universidad Tecnológica de Chalmers, bajo el liderazgo de Martin Andersson en el Departamento de Química e Ingeniería Química, ahora ha utilizado con éxito la tomografía con sonda atómica para obtener imágenes y estudiar proteínas. La tomografía con sonda atómica existe desde hace un tiempo, pero no se ha utilizado anteriormente de esta manera, sino para investigar metales y otros materiales duros.
"Fue en relación con un estudio de las superficies de contacto entre el esqueleto y los implantes cuando descubrimos que podíamos distinguir materiales orgánicos en el hueso con esta técnica. Eso nos dio la idea de desarrollar más el método para las proteínas, "dice Martin Andersson.
El desafío consistía en desarrollar un método para mantener las proteínas intactas en su entorno natural. Los investigadores lograron esto con éxito al encapsular la proteína en una pieza de vidrio extremadamente delgada, solo alrededor de 50 nanómetros de diámetro (un nanómetro es una millonésima parte de un milímetro). Luego cortaron la capa más externa del vidrio usando un campo eléctrico, liberando la proteína átomo por átomo. Luego, la proteína podría recrearse en 3-D en una computadora.
Los resultados del estudio se han verificado mediante la comparación con modelos tridimensionales existentes de proteínas conocidas. En el futuro, los investigadores perfeccionarán el método para mejorar la velocidad y la precisión.

Martin Andersson. Crédito:Johan Bodell / Universidad Tecnológica de Chalmers
El método es innovador de varias maneras. Además de modelar la estructura tridimensional, simultáneamente revela la composición química de las proteínas.
"Nuestro método ofrece muchas buenas soluciones y puede ser un fuerte complemento de los métodos existentes. Será posible estudiar cómo se construyen las proteínas a nivel atómico, "dice Andersson.
Con este método, potencialmente todas las proteínas pueden ser estudiadas, algo que actualmente no es posible. Hoy dia, sólo alrededor del uno por ciento de las proteínas de membrana se han analizado estructuralmente con éxito.
"Con este método, podemos estudiar proteínas individuales, a diferencia de los métodos actuales que estudian una gran cantidad de proteínas y luego crean un valor medio, "dice Gustav Sundell, investigador del grupo de investigación de Andersson.
Con tomografía por sonda atómica, también se puede derivar información sobre la masa de un átomo.
"Debido a que recopilamos información sobre las masas de los átomos en nuestro método, significa que podemos medir el peso. Entonces podemos, por ejemplo, crear pruebas donde las moléculas medicinales se combinen con diferentes isótopos, dándoles diferentes masas, lo que las hace distinguibles en un estudio. Debería contribuir a acelerar los procesos de construcción y prueba de nuevos medicamentos. "dice Mats Hulander, investigador del grupo de Andersson.