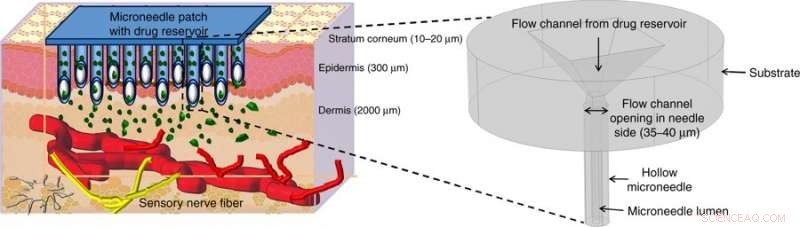
Entrega de fármacos ilustrada utilizando microagujas huecas (MN). Los MN huecos perforan la piel para llegar por encima de los nervios sensibles al dolor en la región transdérmica de la piel y liberan el fármaco sin dolor mediante métodos de actuación adecuados. La figura al principio muestra una vista ampliada de la estructura de microagujas propuesta en este trabajo. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0039-9.
Las microagujas están diseñadas para infundir medicamentos de forma transdérmica (a través de la piel) y relativamente sin dolor durante las aplicaciones clínicas. En un estudio reciente, Richa Mishra y sus colegas desarrollaron una nueva técnica para convertir películas de polímero en una forma vítrea de carbono resistente a las fracturas para desarrollar microagujas. El dispositivo optimizado de administración de fármacos transdérmicos se fabricó mediante fotolitografía para formar una microaguja biocompatible y robusta para aplicaciones preclínicas.
Los científicos primero generaron una matriz de verticales, Tubos huecos hechos del polímero SU-8 a base de epoxi sobre un sustrato de silicio. Las microestructuras se afilaron en formas similares a agujas mediante tratamiento térmico en un horno sin oxígeno y el producto final se compuso completamente de átomos de carbono ordenados al azar. La caracterización de materiales posterior incluyó nanoindentación para medir la rigidez de la superficie. Las estructuras de carbono vítreo eran lo suficientemente robustas como para penetrar la piel humana sin romperse. Los resultados del estudio se publicaron el Microsistemas y nanoingeniería .
Los autores detallaron el proceso convencional del sistema microelectromecánico de carbono (C-MEMS) utilizado para fabricar las microagujas. En el proceso, Mishra y col. utilizó un paso de pirólisis escalable e irreversible, donde el precursor de microagujas SU-8 pre-modeladas se convirtió en estructuras de carbono vítreo. Los experimentos se llevaron a cabo en una atmósfera inerte a altas temperaturas (~ 900 0 C) para conservar su forma original después de encogerse. Al convertirse en carbono vítreo, las microagujas heredaron las propiedades asociadas de dureza, biocompatibilidad, Resistencia térmica y química.
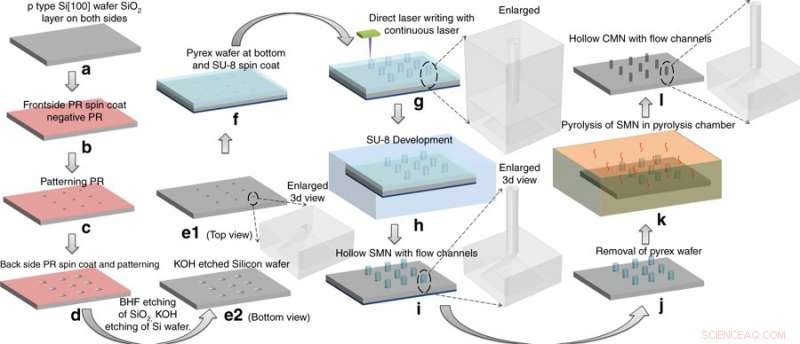
Proceso de fabricación:conversión de microagujas SU-8 (SMN) en microagujas huecas de carbono vítreo (CMN) por pirólisis. Las estructuras SMN se encogieron conservando su geometría general. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0039-9
Los investigadores compararon la dureza y el módulo de Young de las microagujas de carbono y SU-8 para comprender el aumento de fuerza inducido por el proceso C-MEMS. Posteriormente se estimó la contracción estructural de las microagujas de carbono por pirólisis. Mishra y col. llevó a cabo una caracterización en profundidad de materiales con espectroscopía de rayos X de dispersión de energía (EDX) para comprender la química de la superficie y la espectroscopía Raman para estimar el porcentaje atómico de carbono en la estructura cristalina de la microaguja.
Los resultados confirmaron la composición vítrea de las microagujas. Pruebas adicionales de compresión y flexión determinaron las fuerzas máximas que podían soportar las microagujas. Los dispositivos podían soportar fuerzas que eran aproximadamente dos órdenes de magnitud más altas que las fuerzas resistivas de la piel. Posteriormente, los dispositivos se probaron en la superficie de la piel de un modelo de ratón en el estudio.
El uso de carbono en medicina no es nuevo; los ejemplos incluyen aplicaciones en articulaciones ortopédicas, como fibras / compuestos de carbono en cirugías ortopédicas y como materiales en instrumentos quirúrgicos. Las propiedades de las fibras de carbono para formar estructuras tridimensionales similares a andamios han demostrado una capacidad prometedora en la regeneración del tejido óseo. Las propiedades personalizadas del carbono lo han hecho adecuado para fabricar microagujas de administración transdérmica de fármacos (MN) para la administración avanzada de fármacos y vacunas.
Por competencia, Los MN deben tener una longitud óptima para una administración eficaz del fármaco, pero sea lo suficientemente corto para evitar causar dolor. Los científicos de materiales están explorando estrategias para seleccionar materiales y métodos clínicamente viables que puedan traducirse comercialmente en un corto período de tiempo.
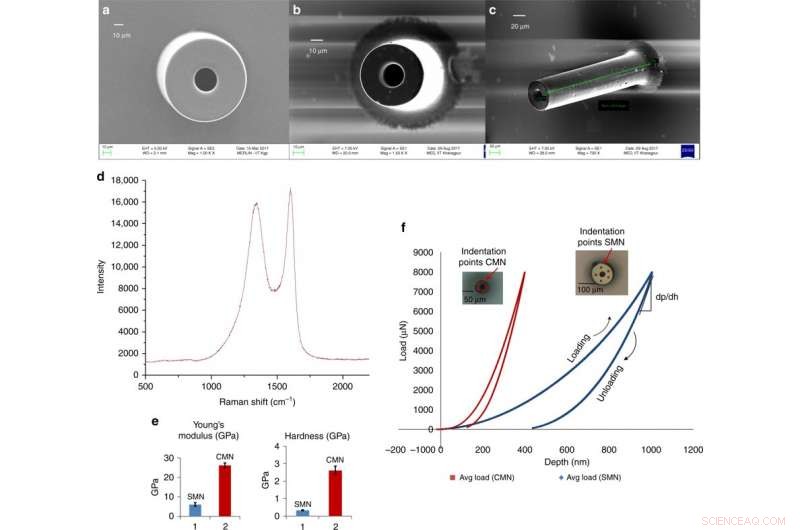
Microagujas de carbono vítreo para la administración transdérmica de fármacos derivados de un proceso C-MEMS escalable. a) Micrografía electrónica de barrido de un SMN (diámetro exterior 100 μm, diámetro interior 50 μm). b) MN pirolizado correspondiente. c) Vista inclinada del mismo CMN. d) Espectro Raman de la microaguja de carbono. e) Comparación del módulo de Young y la dureza para el SU-8 y los MN de carbono. f) Datos de carga frente a desplazamiento para un SMN y el correspondiente CMN pirolizado. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0039-9.
Los requisitos clave para los MN incluyen biocompatibilidad, concentración y administración controlada del fármaco. Los MN sólidos se pueden desarrollar con polímeros, silicio, acero, titanio y níquel mediante procesos sustractivos o aditivos. Una desventaja de los MN sólidos es su capacidad limitada para la administración óptima de fármacos. Por otra parte, Los MN huecos se pueden unir a un depósito de fármaco con presión externa para una administración óptima del fármaco.
Mishra y col. eligió el precursor SU-8 por su alta resistencia a la reticulación, biocompatibilidad, bajo costo, polimerización inducida por luz y compatibilidad con el proceso de la industria microelectrónica. Para fabricar hueco, microagujas de carbono vítreo (CMN), el proceso C-MEMS se adaptó por primera vez al patrón de microagujas SU-8 (SMN) utilizando escritura láser directa, seguido de su conversión en CMN vítreos mediante pirólisis. Los puertos de microfluidos se grabaron en una oblea de silicio, según un protocolo previo desarrollado por el mismo equipo de investigación. Los productos resultantes (CMN) se caracterizaron por sus propiedades mecánicas, incluyendo la dureza y el módulo de Young en comparación con sus SMN precursores. Los resultados indicaron que los CMN eran superiores.
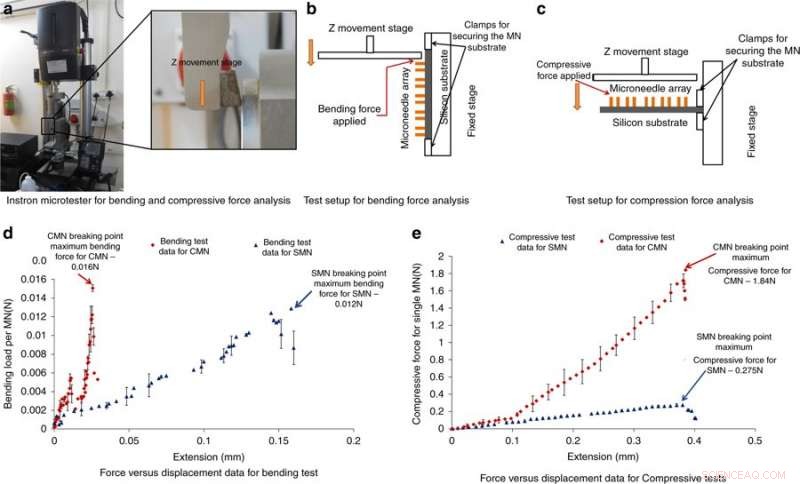
Microtester Instron para análisis y resultados de fuerzas de flexión y compresión. a) Fotografía del microtester Instron empleado para el análisis de fuerzas de flexión y compresión. b) Configuración de prueba para el análisis de la fuerza de flexión. c) Configuración de prueba para análisis de fuerza de compresión. d) Resultados de fuerza versus desplazamiento de la prueba de flexión. e) Resultados de fuerza versus desplazamiento de la prueba de compresión. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0039-9
Mishra y col. observaron y cuantificaron las dimensiones de los precursores de SMN y las correspondientes estructuras de CMN pirolizadas utilizando imágenes de microscopía electrónica de barrido (SEM). Después de la pirólisis, el diámetro y el grosor de la pared de la microaguja disminuyeron. Los resultados de EDX mostraron un mayor porcentaje atómico de elementos de carbono para los MN de carbono. La ausencia de nitrógeno en la composición de la microaguja de carbono indicó su eliminación durante el calentamiento. El porcentaje de contenido de oxígeno se debió a la estructura del CMN y al Si / SiO 2 superficie del sustrato. La espectroscopía Raman mostró la naturaleza cristalina vítrea de la microestructura final mediante la verificación del producto de carbono. Los resultados coincidieron con estudios previos.
Los científicos obtuvieron datos de desplazamiento de carga a través de nanoindentación para las estructuras de carbono y SU-8 separadas. Calcularon la dureza y el módulo de elasticidad utilizando el modelo de Oliver Pharr. Los resultados mostraron una dureza de 0,33 GPa y un módulo de Young de 5,52 GPa para SMN. En la conversión a CMN mediante pirólisis, los resultados de la indentación mostraron una mayor elasticidad del material, la dureza aumentó ocho veces hasta 2,62 GPa y el módulo de Young aumentó 4,8 veces hasta 26,97 GPa.
Para comprender la capacidad de los MN para resistir fuerzas sin romperse durante la inserción en la piel, Mishra y col. Realización de mediciones de fuerza de flexión y compresión de la estructura. Típicamente, un MN experimenta resistencia durante la penetración de la piel, por tanto, la fuerza aplicada debe ser mayor que la fuerza opuesta. Para probar la flexión / compresión, los MN se cargaron en un microprobador Instron y se empujó una placa de metal hacia los MN hasta que se rompieron; si la carga aplicada estaba por debajo de la fuerza máxima de compresión o flexión, las agujas no se romperán. Una fuerte caída en la fuerza de compresión o fuerza de flexión indicó un punto de fractura. Los resultados mostraron que los CMN eran mucho más fuertes que los precursores, permitiéndoles vencer la resistencia durante la penetración de la piel.
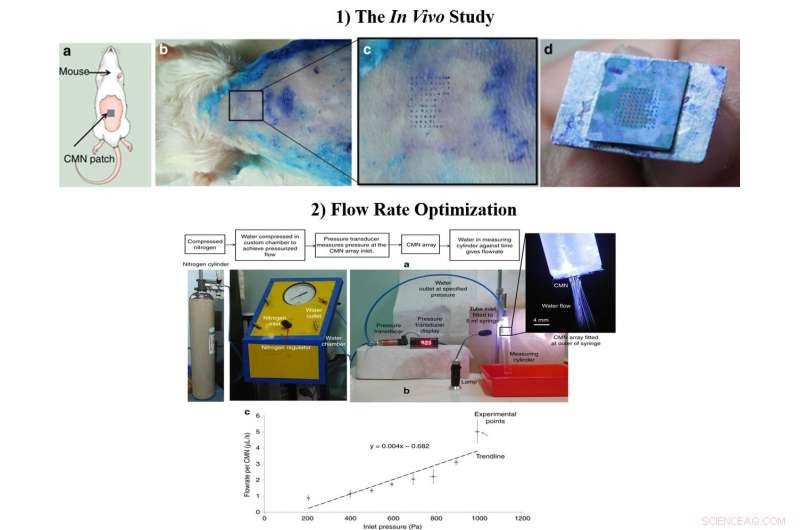
1) El estudio in vivo a) Esquema de la prueba de inserción de MN en ratones. b) Prueba de inserción biológica realizada en ratones Swiss Albino de 6 a 8 semanas de edad. c) Vista ampliada del área de la piel perforada por los CMN. d) Matriz intacta de 10 × 10 después de múltiples inserciones. 2) El caudal optimizado, a) Configuración de prueba para la medición del caudal. b) Caudal por microaguja a diferentes presiones de entrada. Crédito:Microsistemas y Nanoingeniería, doi:https://doi.org/10.1038/s41378-018-0039-9
Después de confirmar el carácter mecánico y la superioridad de los CMN huecos en el laboratorio, Richa Mishra y sus colaboradores realizaron experimentos in vivo para probar los CMN en la piel del ratón. Se presionó una matriz de microagujas recién sumergida en azul de metileno sobre la piel de un modelo de ratón Swiss Albino y se retiró lentamente varias veces. Las marcas de aguja de azul de metileno eran visibles, los MN permanecieron intactos después de múltiples inserciones y un espaciado de matriz de 500 µm fue óptimo para más estudios en el laboratorio.
Los científicos optimizaron las dimensiones del flujo durante el proceso de fabricación e incluyeron conductos de microfluidos de tamaño reducido para mejorar la funcionalidad de MN. Para probar los caudales, conectaron una jeringa de 5 ml con una cámara personalizada que contenía agua desionizada. Cuando los científicos midieron la tasa de flujo promedio versus la presión para MN individuales, los resultados mostraron que la administración del fármaco se podía controlar en última instancia modificando la presión de entrada.
La técnica de caracterización de materiales definitiva en el estudio fue la nanoindentación, ya que el parámetro cuantificó la dureza superficial y el módulo de Young para verificar la superioridad de los CMN. El trabajo futuro incluirá el desarrollo de la administración controlada de medicamentos, con microbomba y depósito de fármaco integrados al diseño MN. De este modo, los científicos tienen como objetivo desarrollar sistemas avanzados de administración de medicamentos y vacunas en la atención médica que sean rentables, precisa e indolora para el paciente.
© 2019 Science X Network