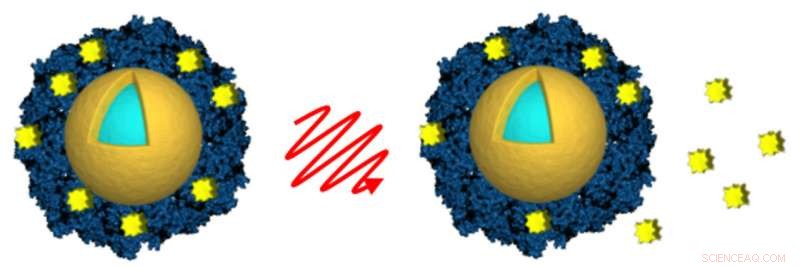
Investigadores de la Universidad de Rice y la Universidad de Northwestern cargaron nanoconchas (doradas y azul claro) activadas por la luz con el fármaco contra el cáncer lapatinib (amarillo) al envolver el fármaco en un sobre de albúmina (azul). La luz de un láser de infrarrojo cercano (centro) se utilizó para activar de forma remota la liberación del fármaco (derecha) después de que las células cancerosas absorbieran las nanocapas. Crédito:A. Goodman / Rice University
Los investigadores que investigan formas de administrar dosis altas de medicamentos contra el cáncer dentro de los tumores han demostrado que pueden usar un láser y nanopartículas de oro activadas por luz para desencadenar de forma remota la liberación de medicamentos contra el cáncer aprobados dentro de las células cancerosas en cultivos de laboratorio.
El estudio realizado por investigadores de la Rice University y la Northwestern University Feinberg School of Medicine aparece en la edición temprana en línea de esta semana de la procedimientos de la Academia Nacional de Ciencias . Empleó nanoconchas de oro para administrar dosis tóxicas de dos fármacos, lapatinib y docetaxel, dentro de las células del cáncer de mama. Los investigadores demostraron que podían usar un láser para activar de forma remota las partículas para liberar los medicamentos después de que ingresaran a las células.
Aunque las pruebas se realizaron con cultivos celulares en un laboratorio, la investigación fue diseñada para demostrar la aplicabilidad clínica:las nanopartículas no son tóxicas, las drogas son ampliamente utilizadas y de bajo consumo, El láser infrarrojo puede brillar de forma no invasiva a través del tejido y llegar a los tumores a varios centímetros por debajo de la piel.
"En estudios futuros, planeamos utilizar una estrategia de caballo de Troya para introducir las nanocapas cargadas de fármacos dentro de los tumores, "dijo Naomi Halas, un ingeniero, químico y físico de la Universidad de Rice que inventó las nanoconchas de oro y ha pasado más de 15 años investigando su potencial contra el cáncer. "Macrófagos, un tipo de glóbulo blanco que se ha demostrado que penetra en los tumores, llevará los complejos fármaco-partícula a los tumores, y una vez allí usamos un láser para liberar las drogas ".
Coautora Susan Clare, profesor asociado de investigación de cirugía en la Facultad de Medicina Feinberg de la Universidad Northwestern, dijo que el estudio PNAS fue diseñado para demostrar la viabilidad del enfoque del caballo de Troya. Además de demostrar que los medicamentos pueden liberarse dentro de las células cancerosas, el estudio también mostró que en los macrófagos, las drogas no se desprendieron antes de activarse.
"Conseguir que los fármacos quimioterapéuticos penetren en los tumores es muy complicado, "dijo Clare, también cirujano de cáncer de mama de Northwestern Medicine. "Los medicamentos tienden a salir de los tumores en lugar de extraerlos. Para obtener una dosis eficaz en el tumor, los pacientes a menudo tienen que tomar tanta cantidad del fármaco que las náuseas y otros efectos secundarios se agravan. Nuestra esperanza es que la combinación de macrófagos y la liberación de fármacos activada aumente la dosis eficaz de fármacos dentro de los tumores para que los pacientes puedan tomar menos en lugar de más ".
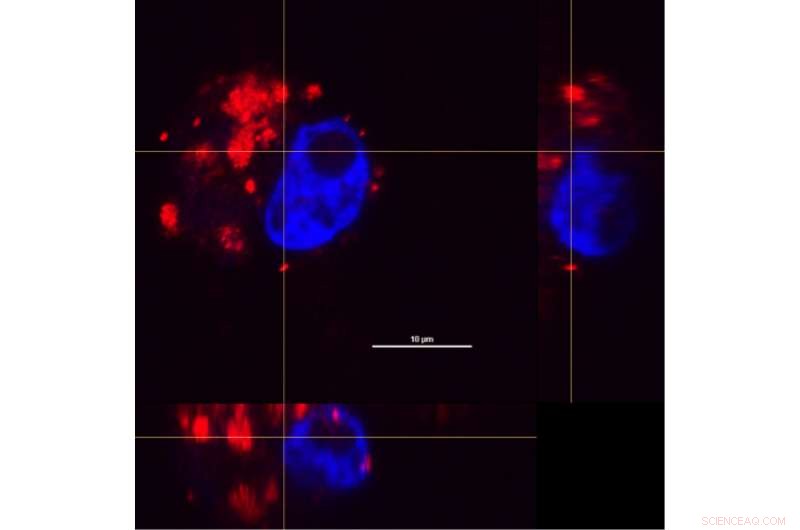
Al combinar secciones transversales de una célula de macrófagos de la x-, ejes y y z, Los investigadores pudieron examinar cómo se distribuían los complejos de nanocáscara-fármaco (rojo) dentro de las células después de un período de incubación de 24 horas. Se utilizó un tinte para distinguir el núcleo celular (azul). Crédito:O. Neumann / Rice University
Si el enfoque funciona, Clare dijo:podría resultar en menos efectos secundarios y potencialmente usarse para tratar muchos tipos de cáncer. Por ejemplo, uno de los fármacos del estudio, lapatinib, forma parte de una amplia clase de quimioterapias llamadas inhibidores de la tirosina quinasa que se dirigen a proteínas específicas vinculadas a diferentes tipos de cáncer. Otros medicamentos aprobados por la Administración Federal de Drogas en su clase incluyen imatinib (leucemia), gefitinib (mama, pulmón), erlotinib (pulmón, pancreático), sunitinib (estómago, riñón) y sorafenib (hígado, tiroides y riñón).
"Todos los inhibidores de la tirosina quinasa son notoriamente insolubles en agua, "dijo Amanda Goodman, una alumna de Rice y autora principal del estudio PNAS. "Como clase de drogas, tienen poca biodisponibilidad, lo que significa que una proporción relativamente pequeña del fármaco en cada píldora en realidad está matando las células cancerosas. Si nuestro método funciona para el lapatinib y el cáncer de mama, también puede funcionar con los otros medicamentos de la clase ".
Halas inventó nanoconchas en Rice en la década de 1990. Aproximadamente 20 veces más pequeño que un glóbulo rojo, están hechos de una esfera de vidrio cubierta por una fina capa de oro. Las nanoconchas se pueden sintonizar para capturar energía de longitudes de onda de luz específicas, incluyendo infrarrojo cercano (infrarrojo cercano), una longitud de onda no visible que atraviesa la mayoría de los tejidos del cuerpo. Biociencias de Nanospectra, un licenciatario de esta tecnología, ha realizado varios ensayos clínicos durante la última década utilizando nanoconchas como agentes fototérmicos que destruyen tumores con luz infrarroja.
La colaboración de Clare y Halas en la administración de fármacos basados en nanoconchas comenzó hace más de 10 años. En un trabajo anterior, demostraron que un láser de onda continua de infrarrojo cercano, el mismo tipo que produce calor en las aplicaciones fototérmicas de las nanocapas, podría utilizarse para desencadenar la liberación de fármacos de las nanocapas.
En el último estudio, Goodman contrastó el uso de activación y activación de láser de onda continua con un láser de pulso de baja potencia. Usando cada tipo de láser, ella demostró la liberación de drogas activada de forma remota a partir de dos tipos de conjugados de nanocáscara-fármaco. Un tipo usó un enlazador de ADN y el fármaco docetaxel, y el otro empleó una capa de albúmina de proteína sanguínea para atrapar y retener el lapatinib. En cada caso, Goodman descubrió que podía desencadenar la liberación del fármaco después de que las nanoconchas fueran absorbidas dentro de las células cancerosas. Tampoco encontró una liberación prematura mensurable de fármacos en los macrófagos en ninguno de los casos.
Halas y Clare dijeron que esperan comenzar pronto las pruebas con animales de la tecnología y tener un modelo de ratón establecido que podría usarse para las pruebas.
"Estoy particularmente entusiasmado con el potencial del lapatinib, "Dijo Clare." La primera vez que escuché sobre el trabajo de Naomi, Me pregunté si podría ser la respuesta para administrar medicamentos en el interior anóxico (sin oxígeno) de los tumores, donde acechan algunas de las células cancerosas más agresivas. Como médicos, siempre estamos buscando formas de evitar que el cáncer regrese meses o años después, y espero que esto pueda hacer eso ".