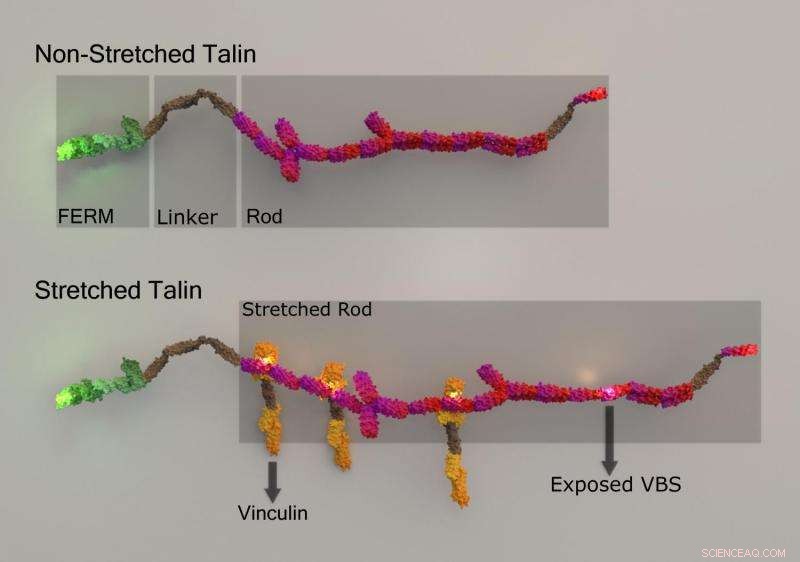
Estiramiento de Talin y unión de vinculina inducida por estiramiento. Crédito:Universidad Nacional de Singapur
Investigadores del Instituto de Mecanobiología (MBI) de la Universidad Nacional de Singapur han desarrollado un nuevo método, utilizando microscopía de superresolución, para determinar la longitud de las proteínas estiradas en las células vivas, y monitorear la unión dinámica de proteínas, en escalas de tiempo inferiores a un segundo. Este estudio fue publicado en Nano letras en mayo de 2016.
Las células están constantemente expuestas a fuerzas mecánicas. Estas señales influyen en la toma de decisiones celular al proporcionar información que las células necesitan para determinar qué cantidad de una proteína en particular producir. cuándo debe expresarse un gen específico, o incluso si una celda debe moverse o permanecer donde está. Dicha información es crucial, por ejemplo, en el mantenimiento de la salud, integridad y reparación de los tejidos a medida que envejecemos. Un claro ejemplo de cuando las células están expuestas a fuerzas es cuando caminamos. Las fuerzas de estiramiento o tracción se generan dentro de nuestros músculos, y estos pasan a través del músculo al tejido conectivo y al hueso. Aunque esta información se genera a nivel de tejido, converge en células individuales dentro de esos tejidos, y es detectado y medido por subcelular, a base de proteínas, máquinas.
Para medir las fuerzas aplicadas a una celda, las proteínas especializadas pueden deformarse. Una forma común de que esto ocurra es cuando se estira una proteína, al igual que una banda elástica se estira cuando se somete a fuerzas de tracción. El estiramiento de las proteínas puede exponer regiones dentro de ellas que de otro modo estarían ocultas. Estas regiones pueden servir como sitios de acoplamiento para la unión de otras proteínas. Esto conduce a un efecto de bola de nieve, donde cada vez más proteínas pueden unirse, y se forman máquinas o complejos moleculares más grandes para mediar en una función celular específica. Este fenómeno fue explorado recientemente por MBI Director, Profesor Michael Sheetz, Investigador principal Dr. Felix Margadant y estudiante de doctorado Sra. Xian Hu (Edna), en un trabajo centrado en caracterizar el estiramiento de una proteína sensible a la fuerza conocida como talina, y establecer el efecto que tiene sobre la unión de otra proteína llamada vinculina.
Aunque varios estudios han demostrado el estiramiento inducido por la fuerza de la unión de talina y talina-vinculina in vitro, La visualización simultánea de ambos eventos y su correlación con funciones celulares específicas no era posible anteriormente en células vivas debido a las escalas de tiempo rápidas en las que ocurren. También, la realización de imágenes de superresolución multicolor en células vivas sigue siendo muy difícil. Para superar estos desafíos, El profesor Sheetz y la Sra. Hu desarrollaron una novela, y un método de imágenes de superresolución muy avanzado, que les permitió monitorear simultáneamente la longitud de la talina en las células vivas, así como la dinámica de la unión de vinculina, a nivel de molécula única y escala de tiempo de milisegundos.
Al unir diferentes moléculas fluorescentes (GFP y mCherry), a cada extremo de la talina y un tercer fluoróforo (Atto655) a vinculina, los investigadores pudieron monitorear la ubicación subcelular precisa de cada proteína, y confirme que cuando se estiró el talin, vinculina unida a sitios recientemente expuestos. Curiosamente, sus hallazgos a menudo revelaron enlaces agrupados, con cinco o más moléculas de vinculina que se unen a la talina en un segundo. Es más, la unión de las primeras vinculinas pareció favorecer energéticamente la unión sucesiva de más moléculas de vinculina. Correlacionar la dinámica de unión de vinculina con la cantidad de estiramiento de talina, los investigadores notaron que la unión máxima de vinculina se produjo en un extremo específico de la talina (la región N-terminal), cuando la talina se estiró hasta aproximadamente 180 nm.
Comprender cómo responden la talina y la vinculina a las fuerzas de estiramiento es fundamental para comprender cómo responden las células a las fuerzas de nuestro cuerpo. En este caso, ambas proteínas se encuentran en una maquinaria molecular más grande llamada adherencias focales, que conectan físicamente el interior de una celda con el material que la rodea, la matriz extracelular. Las adherencias focales funcionan principalmente como centros de retransmisión de señales, y la información que transfieren puede inducir el crecimiento celular y el movimiento celular. Cuando se interrumpe el procesamiento de esta señal, o no está regulado, surgen estados de enfermedad y la capacidad del cuerpo para curar heridas, o mantener la integridad de los tejidos a medida que envejecemos.
Aunque es importante para facilitar estos procesos celulares y tisulares más amplios, la interacción talina-vinculina es solo una de las muchas interacciones de proteínas para responder a la fuerza. Se espera que este método recién descrito allane el camino para que los investigadores analicen otras interacciones de proteínas, ambos dentro de adherencias focales, y en otras máquinas moleculares, para mejorar nuestra comprensión de los muchos procesos celulares impulsados por la fuerza que surgen durante el desarrollo y continúan hasta el envejecimiento.