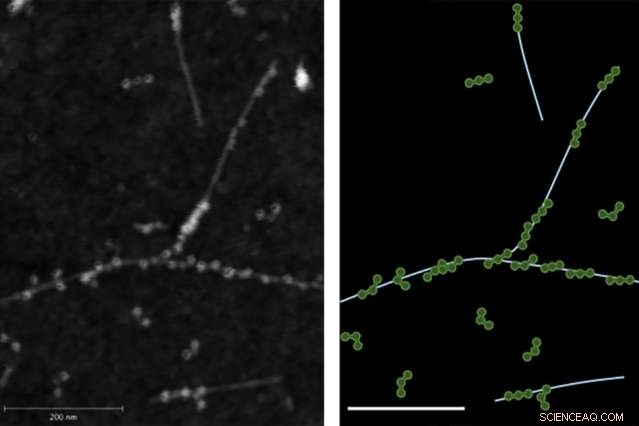
La imagen de microscopía de fuerza atómica (AFM) de la izquierda demuestra la unión física entre las proteínas de fibrinógeno y los nanotubos de carbono de pared simple. La derecha muestra un rastro de la imagen AFM con el fibrinógeno en verde y los nanotubos en azul claro.
Usando nanotubos de carbono, Los ingenieros químicos del MIT han ideado un nuevo método para detectar proteínas, incluyendo fibrinógeno, uno de los factores de coagulación críticos para la cascada de coagulación sanguínea.
Este enfoque, si se convierte en un sensor implantable, podría ser útil para controlar a los pacientes que toman anticoagulantes, permitir que los médicos se aseguren de que los medicamentos no interfieran demasiado con la coagulación de la sangre.
El nuevo método es el primero en crear sitios de reconocimiento sintéticos (similares a los anticuerpos naturales) para proteínas y acoplarlos directamente a un poderoso nanosensor como un nanotubo de carbono. Los investigadores también han logrado un progreso significativo en un sitio de reconocimiento similar para la insulina, lo que podría permitir un mejor seguimiento de los pacientes con diabetes. También es posible utilizar este enfoque para detectar proteínas asociadas con el cáncer o las enfermedades cardíacas. dice Michael Strano, el profesor Carbon P. Dubbs en Ingeniería Química en el MIT.
Strano es el autor principal de un artículo que describe el método en Nature Communications. Gili Bisker, un postdoctorado en el laboratorio de Strano, es el autor principal del artículo.
Una búsqueda dirigida
El nuevo sensor es el último ejemplo de un método desarrollado en el laboratorio de Strano, conocido como Reconocimiento Molecular de Fase Corona (CoPhMoRe).

Esta imagen de microscopía electrónica de barrido muestra nanotubos de carbono de pared simple, el material de partida utilizado por los investigadores.
Esta técnica aprovecha las interacciones entre un polímero dado y una superficie de nanopartículas como la de un nanotubo de carbono de pared simple fluorescente, cuando el polímero se envuelve alrededor del nanotubo.
Ciertas regiones de los polímeros se adhieren a la superficie de las nanopartículas como anclajes, mientras que otras regiones se extienden hacia el exterior en su entorno. Esta región que mira hacia afuera, también conocida como fase adsorbida o corona, tiene una estructura tridimensional que depende de la composición del polímero.
CoPhMoRe funciona cuando un polímero específico se adsorbe en la superficie de la nanopartícula y crea una corona que reconoce la molécula objetivo. Estas interacciones son muy específicas, al igual que la unión entre un anticuerpo y su objetivo. La unión del objetivo altera la fluorescencia natural de los nanotubos de carbono, permitiendo a los investigadores medir qué cantidad de la molécula diana está presente.
El laboratorio de Strano ha utilizado previamente este enfoque para encontrar sitios de reconocimiento y desarrollar sensores de oxígeno para estradiol y riboflavina. entre otras moléculas. El nuevo artículo representa su primer intento de identificar fases corona que pueden detectar proteínas, que son más grandes, mas complejo, y más frágil que las moléculas identificadas por sus sensores anteriores.
Para este estudio, Bisker comenzó analizando nanotubos de carbono envueltos en 20 polímeros diferentes, incluido el ADN, ARN, y polietilenglicol (PEG), un polímero que a menudo se agrega a los medicamentos para aumentar su longevidad en el torrente sanguíneo.
En su propia, ninguno de los polímeros tenía afinidad por las 14 proteínas probadas, todo tomado de sangre humana. Sin embargo, cuando los investigadores probaron nanotubos envueltos en polímero contra las mismas proteínas, encontraron una coincidencia entre uno de los nanotubos modificados y el fibrinógeno.
"Un químico o un biólogo no podrían predecir de antemano que debería haber algún tipo de afinidad entre el fibrinógeno y esta fase de corona". "Dice Strano." Realmente es un nuevo tipo de reconocimiento molecular ".
Fibrinógeno, una de las proteínas más abundantes en la sangre humana, es parte de la cascada de coagulación sanguínea. Cuando un vaso sanguíneo está dañado, una enzima llamada trombina convierte el fibrinógeno en fibrina, una proteína fibrosa que forma coágulos para sellar la herida.
Un sensor de fibrinógeno podría ayudar a los médicos a determinar si los pacientes que toman anticoagulantes aún tienen suficiente capacidad de coagulación para protegerlos de lesiones. y podría permitir a los médicos calcular dosis más precisas. También podría usarse para analizar la coagulación sanguínea de los pacientes antes de que se sometan a una cirugía. o para controlar la cicatrización de heridas, Bisker dice.
Anticuerpos sintéticos
Los investigadores creen que sus agentes sintéticos de reconocimiento molecular son una mejora con respecto a los sistemas naturales existentes basados en anticuerpos o secuencias de ADN conocidas como aptámeros. que son más frágiles y tienden a degradarse con el tiempo.
"Una de las ventajas de esto es que es un sistema completamente sintético que puede tener una vida útil mucho más larga dentro del cuerpo, "Dice Bisker.
En 2013, Los investigadores del laboratorio de Strano demostraron que los sensores de nanotubos de carbono pueden permanecer activos en ratones durante más de un año después de ser incrustados en un gel de polímero e implantados quirúrgicamente debajo de la piel.
Además de la insulina, los investigadores también están interesados en detectar troponina, una proteína que se libera al morir las células del corazón, o detectar proteínas asociadas con el cáncer, que sería útil para controlar el éxito de la quimioterapia. Estos y otros sensores de proteínas podrían convertirse en componentes críticos de los dispositivos que administran medicamentos en respuesta a una señal de enfermedad.
"Al medir los marcadores terapéuticos en el cuerpo humano en tiempo real, podemos habilitar sistemas de administración de medicamentos que son mucho más inteligentes, y liberar drogas en cantidades precisas, "Dice Strano". Sin embargo, la medición de esos biomarcadores es el primer paso ".