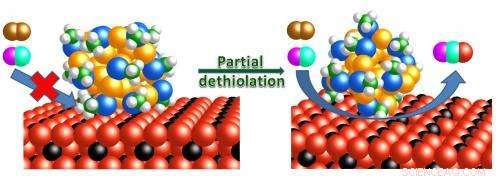
El mecanismo de reacción de la oxidación del monóxido de carbono se muestra sobre nanoclusores de oro intactos y parcialmente removidos con ligando soportados sobre varillas de óxido de cerio. Crédito:Wu, Z., et al.
(Phys.org) —El pensamiento antiguo era que el oro, si bien es bueno para la joyería, no fue de mucha utilidad para los químicos porque es relativamente no reactivo. Eso cambió hace una década cuando los científicos encontraron una rica veta de descubrimientos que revelaron que este noble metal, cuando se estructura en partículas de tamaño nanométrico, puede acelerar las reacciones químicas importantes para mitigar los contaminantes ambientales y producir productos químicos especiales difíciles de fabricar. Desde entonces, las nanopartículas de oro catalítico han estimulado cientos de artículos de revistas científicas. Con el mercado mundial de catalizadores a punto de alcanzar los 19.500 millones de dólares en 2016, las nanopartículas de oro pueden tener una importancia tanto comercial como intelectual, ya que, en última instancia, podrían conducir a nuevos catalizadores de energía, farmacología y diversos productos de consumo.
Pero antes de que las nanopartículas de oro puedan ser útiles para los consumidores, los investigadores tienen que hacerlos tanto estables como activos. Recientemente, los científicos aprendieron a hacer pequeños, cúmulos muy ordenados con números muy específicos de átomos de oro que son estabilizados por compuestos llamados ligandos. Estos grupos de oro estabilizados más ligandos pueden considerarse moléculas grandes. En colaboración con científicos de la Universidad Carnegie Mellon, Los investigadores del Laboratorio Nacional Oak Ridge del Departamento de Energía han encontrado una nueva molécula de oro, un catalizador que contiene exactamente 25 átomos de oro, que es tan poderoso como sofisticado. Cataliza la conversión de una variedad de moléculas, incluida la transformación de monóxido de carbono venenoso en dióxido de carbono inofensivo, una reacción que puede encontrar aplicación en dispositivos cerca de chimeneas de gas o estufas de leña. Desafortunadamente, los ligandos que crean y estabilizan los grupos diseñados también bloquean los mismos sitios necesarios para catalizar la conversión de monóxido de carbono en dióxido de carbono.
"Los ligandos son espadas de doble filo, "dijo el líder del estudio Zili Wu de ORNL, cuya investigación se llevó a cabo en el grupo de catálisis de ORNL, que está dirigido por Steve Overbury. "Estamos interesados en usar racimos de oro como catalizadores o precursores de catalizadores. Los ligandos, por un lado, estabilizan la estructura de las partículas de oro, pero por otro lado disminuyen su rendimiento catalítico. Equilibrar esos dos factores es la clave para crear un nuevo sistema catalítico. forma es utilizar un óxido de metal (aquí, óxido de cerio) como ligando inorgánico para estabilizar los grupos de oro cuando el ligando orgánico debe eliminarse para la catálisis ".
Muchos sistemas catalíticos consisten en partículas metálicas con propiedades catalíticas colocadas sobre un soporte de óxido metálico con propiedades catalíticas propias. El metal y el óxido de metal trabajan juntos para crear un nuevo tipo de actividad catalítica. "Estamos tratando de entender cómo sucede eso, "Dijo Wu.
Su estudio, publicado en el Revista de la Sociedad Química Estadounidense , describió cómo los ligandos permitían que el nanocluster de oro se acoplara a un soporte de óxido de cerio con forma de varilla. Los catalizadores producidos fueron todos idénticos. A los investigadores les gustaría diseñar futuros soportes de óxido en forma de cubos u octaedros para descubrir cómo esas nanoestructuras podrían alterar la configuración del oro y la reactividad del sistema de componentes final. Una mejor comprensión de los agentes estabilizantes puede ayudar al diseño de nuevos catalizadores para reacciones químicas críticas, incluida la oxidación, hidrogenación y acoplamiento.
Profesor de Carnegie Mellon Rongchao Jin, su estudiante Chenjie Zeng y los becarios postdoctorales de ORNL Amanda Mann y Zhen-An Qiao sintetizaron los racimos de oro. Mann hizo las varillas de óxido de cerio. Wu y Mann colocaron los racimos de oro sobre los soportes y realizaron estudios de reacciones químicas. David Mullins de ORNL realizó mediciones de la estructura fina de absorción de rayos X extendida para aprender cómo cambian los tamaños de los grupos con la temperatura. Larry Allard de ORNL verificó la naturaleza de las estructuras con microscopía con corrección de aberraciones, y De-en Jiang, antes de ORNL pero ahora en la Universidad de California – Riverside, utilizó el Grupo Institucional de Oak Ridge para explorar computacionalmente estructuras de grupos de oro unidos a ligandos.
Activando el oro
"Estos ligandos afectan la reactividad, esencialmente envenenan la superficie del oro, por lo que el oro realmente tiene que activarse, "Overbury, el autor principal del estudio, explicado. "Ponemos el oro en un soporte, y tiene estos ligandos protegiéndolo. Tenemos que eliminar esos ligandos, así que básicamente calentamos este [nanocluster de oro] o lo tratamos en un poco de gas a temperaturas elevadas ".
Cuando los racimos de oro se calientan, los ligandos comienzan a desprenderse y aumenta la actividad catalítica del oro. La temperatura óptima para producir catalizadores de nanocluster de oro para la oxidación de monóxido de carbono es 498 Kelvin (225 grados Celsius o 437 grados Fahrenheit), Dijo Wu. Si el calentamiento aumenta aún más, catalytic activity decreases because the gold particles become fluid and aggregate on the support.
Next the scientists are interested in varying the gold-cluster size and stabilizing the new clusters to make novel uniform catalysts. "We want to understand how other kinds of reactions can be catalyzed by these. So far we've only looked at carbon monoxide oxidation, which is kind of a test reaction, " Overbury said. "Our primary interest is using the gold-nanocluster complex as a toolbox for learning about how other complex reactions occur."
Added Overbury, "We're only just starting to mine all the catalytic possibilities for gold."
DOE's Office of Science sponsored the research described in the Revista de la Sociedad Química Estadounidense papel. Raman and Fourier transform infrared spectroscopies and catalytic measurements were conducted at the Center for Nanophase Materials Sciences, a DOE Office of Science User Facility at ORNL. Extended X-ray absorption fine structure work was performed at the National Synchrotron Light Source, which is also a DOE Office of Science User Facility, at Brookhaven National Laboratory.