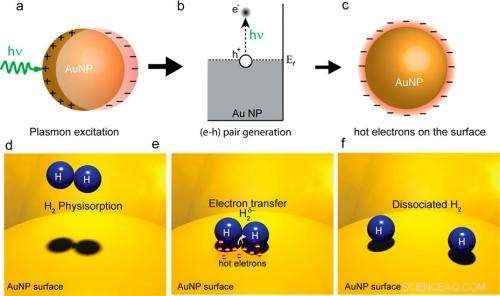
En un), (B), y C), los plasmones de superficie excitados por un láser generan electrones calientes en una superficie de nanopartículas de oro. En (d), (mi), y (f), los electrones calientes se transfieren a las moléculas de H2 y provocan su disociación. Dado que la disociación es el paso que limita la velocidad en muchas reacciones químicas, este proceso de electrones calientes puede aumentar la eficiencia de la reacción. Crédito de la imagen:Shaunak Mukherjee, et al. © 2012 Sociedad Química Estadounidense
(Phys.org) —Desde la refinación de petróleo hasta el procesamiento de alimentos, la gran mayoría de las aplicaciones químicas comerciales involucran catalizadores para controlar la velocidad de las reacciones químicas. Todo lo que pueda aumentar la eficiencia de los catalizadores podría tener un impacto generalizado en estas áreas. En un nuevo estudio, Los científicos han demostrado que una mejora de la eficiencia puede ser posible mediante la creación de electrones "calientes" (aquellos con una energía muy alta) a partir de una superficie metálica en la que se produce la reacción química. y usar los electrones para controlar la reacción química y hacerla más eficiente.
Los investigadores, dirigido por los profesores Peter Nordlander y Naomi J. Halas de Rice University en Houston, Texas, y la profesora Emily A. Carter de la Universidad de Princeton, New Jersey, han publicado su estudio sobre la técnica para mejorar la química catalítica en un número reciente de Nano letras .
En su método, los investigadores utilizaron un láser de luz visible para iluminar una superficie de nanopartículas de oro (la superficie del catalizador) a temperatura ambiente. La luz láser entrante excita ópticamente los plasmones superficiales en la superficie del metal, y los plasmones luego se descomponen en electrones calientes. Debido a sus altas energías, los electrones calientes se extienden más lejos de las nanopartículas que los electrones con energías más bajas. Si otro átomo o molécula que puede aceptar el electrón está cerca, el electrón caliente puede transferirse a los estados electrónicos de ese aceptor.
En estos experimentos, los investigadores adsorbieron H 2 moléculas en la superficie de las nanopartículas de oro, un procedimiento que se realiza comúnmente en catálisis heterogénea, en el que las moléculas adsorbidas actúan como reactivos. Los investigadores encontraron, como resultado principal de su estudio, que algunos de los electrones calientes podrían transferirse a las capas cerradas del H 2 moléculas y hacen que los dos átomos de hidrógeno se separen, o disociar. Este proceso, llamada "disociación de H inducida por plasmón 2 en Au, "Podría mejorar la eficacia de determinadas reacciones químicas".
"En muchas reacciones químicas importantes, el paso que limita la velocidad es la disociación de moléculas de capa cerrada como una molécula de hidrógeno, "Nordlander dijo Phys.org . "Si este paso de reacción se puede 'tratar' (utilizando nuestro proceso de electrones calientes demostrado), la reacción puede proceder mucho más rápido y requerir menos energía ".
Para medir la disociación, los investigadores expusieron el sustrato de nanopartículas tanto a H 2 y D 2 (dos átomos de deuterio, un isótopo de hidrógeno que contiene un neutrón). Si los electrones calientes disociaron estas moléculas, resultaría en la formación de moléculas de HD. Los investigadores encontraron que, tan pronto como encendieron el láser, la tasa de formación de HD en la superficie de las nanopartículas aumentó en un factor de 6. También midieron que la tasa dependía en gran medida de la concentración y el tamaño de las nanopartículas de oro. Los investigadores explicaron que, en un sentido, los electrones "hacen lo imposible" porque no habría disociación sin ellos.
"Una molécula de hidrógeno adsorbida en una superficie macroscópica de oro no se disocia espontáneamente, incluso a temperaturas elevadas, "Dijo Nordlander." Es una reacción química imposible. La energía para la disociación es simplemente demasiado grande. Elegimos el sistema hidrógeno-oro exactamente por esta razón. Queríamos un sistema en el que la interpretación del efecto fuera sencilla. En otros metales, como metales de transición, una molécula de hidrógeno puede disociarse espontáneamente, en particular cerca de defectos y a temperaturas elevadas. Pero no en oro ".
Estos resultados demuestran cómo el campo de la plasmónica, que implica interacciones entre fotones y nanoestructuras, puede tener aplicaciones en el campo de la química catalítica. particularmente fotocatálisis, Los investigadores esperan que esta demostración de la capacidad de controlar las reacciones químicas mediante la luz pueda extenderse para usos específicos. Al usar la frecuencia del láser para sintonizar las resonancias del plasmón de superficie, Puede ser posible crear electrones calientes con energías específicas que pueblan estados electrónicos específicos de moléculas adsorbidas en la superficie de la nanopartícula.
"La aplicación inmediata es mejorar la eficiencia de los catalizadores metálicos iluminándolos con luz, ", Dijo Nordlander." Nuestros grupos tienen una 'agenda verde' muy y nuestra intención es diseñar nuevos tipos de catalizadores que sean impulsados por la luz solar. Esto es algo que tenemos en abundancia aquí en Houston.
"Otra aplicación importante es investigar hasta qué punto podemos dirigir y controlar reacciones químicas haciendo que los electrones calientes de energías particulares se transfieran a orbitales moleculares específicos. Este es un tema de investigación relativamente inexplorado. Los electrones normales tienen energías positivas y son mucho más 'calientes' que nuestros electrones calientes. Estos electrones de alta energía normalmente no permanecen en una molécula el tiempo suficiente para que los átomos comiencen a moverse ".
Copyright 2012 Phys.org
Reservados todos los derechos. Este material puede no ser publicado, transmisión, reescrito o redistribuido total o parcialmente sin el permiso expreso por escrito de Phys.org.