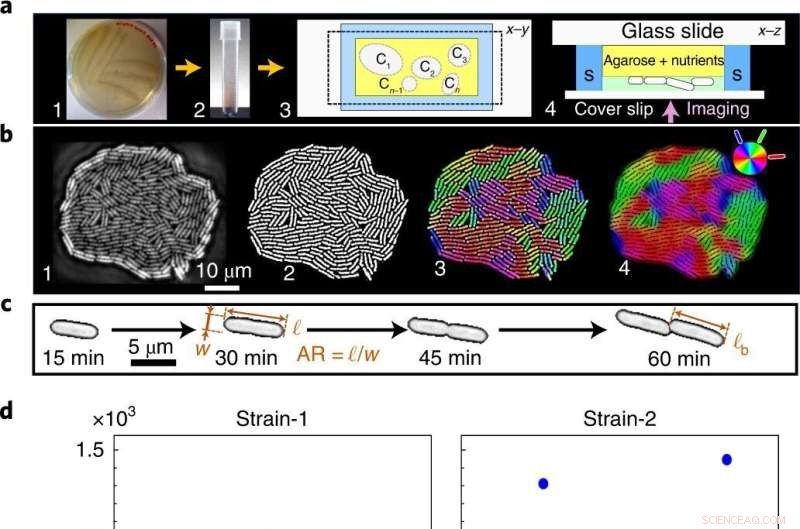
Desde fenotipos ruidosos hasta un evento de transición estadísticamente preciso de mono a multicapa. un , Las células sembradas en placas de agar ricas en nutrientes (1) se transfieren al medio líquido (2), luego se siembran dentro de la cámara microfluídica, aquí Ci denota colonias individuales (3), para imágenes de lapso de tiempo de contraste de fase (4) en la piscina (S). b , Las imágenes sin procesar de colonias en crecimiento (1) se binarizan para extraer rasgos fenotípicos (2) y se codifican por colores para visualizar la orientación de las células locales (3,4). c , Rasgos geométricos unicelulares:AR y ℓ b . d ,e , A c es independiente de la temperatura de crecimiento (d ), como se revela tanto en nuestra teoría como en nuestros experimentos, mientras que t c depende de la temperatura (e ). Los puntos azules y rojos indican distintas réplicas biológicas (incluidas múltiples réplicas técnicas) para A c y t c datos experimentales. A c tiene una gran variación en todos los T , mientras que t c tiene una varianza baja, que se minimiza aún más con la temperatura de crecimiento. f , Ruido fenotípico específico del rasgo, cuantificado como la varianza normalizada, F = var(⋯)/〈⋯〉 2 , a través de T :ℓ b (cuadrados azules), A c (triángulos rojos), tiempo de duplicación de la longitud de la celda τ sc (rombos negros), AR (triángulos magenta) y t c (círculos verdes). A pesar del alto ruido fenotípico a escalas individuales (ℓ b , AR y τ sc ), t c es estadísticamente precisa (el ruido correspondiente es órdenes de magnitud menor en todos los T ). La barra de error indica la desviación estándar de F en las colonias. Crédito:Física de la naturaleza (2022). DOI:10.1038/s41567-022-01641-9
Las bacterias colaboran y se coordinan colectivamente a medida que forman una estructura compartida llamada biopelícula, como la placa dental en nuestros dientes o el microbioma asociado con nuestro intestino. Esta autoorganización en múltiples capas complejas, a pesar de las variaciones de las propiedades celulares a nivel individual, requiere que los sistemas vivos compartan un tiempo común pero preciso, que ahora ha sido descubierto por físicos de la Universidad de Luxemburgo.
El Prof. Anupam Sengupta y su equipo explicaron esto enfocándose en el crecimiento y desarrollo de biopelículas bacterianas nacientes, donde descubren interacciones cruzadas emergentes entre propiedades biofísicas que permiten la sincronización precisa de transiciones estructurales, topológicas e hidrodinámicas a escala de población. Los hallazgos revolucionarios aparecen en la edición reciente de la revista Nature Physics .
Las biopelículas bacterianas se encuentran en casi todas las superficies naturales y artificiales que encontramos. Son cruciales para la existencia humana:desde los que se encuentran en el intestino que regulan nuestro bienestar físico, hasta los que regulan la progresión de los cánceres y mantienen nuestro ecosistema en equilibrio. Gracias a los exquisitos mecanismos de retroalimentación fisicoquímicos que median en sus prolíficos estilos de vida asociados a la superficie, las biopelículas son muy resistentes y pueden colonizar diversos sistemas.
La reciente investigación unicelular realizada por el profesor Sengupta y sus colaboradores ha revelado funciones críticas que desempeñan la geometría unicelular y la dinámica de crecimiento en la configuración de las propiedades dinámicas de las capas bacterianas en crecimiento. Sin embargo, cómo la variabilidad en las estadísticas a nivel celular, un jugador completamente desconocido en los modelos de materia viva y activa existentes, impacta en los fenómenos colectivos emergentes en las biopelículas bacterianas sigue siendo un desafío y, por lo tanto, en gran parte inexplorado.
Ahora, los investigadores del Grupo de Física de la Materia Viva de la Universidad de Luxemburgo resuelven este enigma de larga data:cómo las biopelículas, y los sistemas vivos en general, regulan el momento de los eventos clave del desarrollo que surgen de individuos con atributos altamente variables y dinámicos. Adoptando un enfoque interdisciplinario cuantitativo para espiar dentro de las biopelículas bacterianas nacientes, el equipo del profesor Sengupta proporciona los fundamentos mecánicos de cómo surgen colectivamente los pasos de desarrollo oportunos debido a la autorregulación de los rasgos a nivel celular, que interactúan para mitigar cada uno. los efectos ruidosos de otros, lo que en última instancia permite una sincronización precisa de los eventos clave del desarrollo.
El trabajo profundiza en la racionalización de los resultados, proporcionando una imagen fisiológicamente consistente basada en los requisitos metabólicos durante las primeras etapas del desarrollo del biofilm. Los resultados demuestran cómo la autorregulación del ruido fenotípico impulsa transiciones oportunas en la estructura, la topología y los flujos activos en las colonias bacterianas, lo que destaca el papel estratégico de la física en la comprensión de los sistemas biológicos. El trabajo encaja ampliamente en la iniciativa Physics Meets Biology dentro de la Universidad de Luxemburgo.
Los fenotipos ruidosos impulsan eventos de desarrollo oportunos
A pesar de la variabilidad en los rasgos fenotípicos, como la geometría celular, las tasas de crecimiento y la asociación de superficies, las biopelículas bacterianas pasan por etapas críticas de desarrollo en su ciclo de vida en puntos de tiempo precisos, comenzando con la transición de una a varias capas (MTMT). Después de esta transición estructural clave, se desencadena una cascada emergente, sincronizando sincrónicamente los cambios en la topología y los campos de flujo activo dentro y en las proximidades de las biopelículas nacientes.
El catálogo de rasgos fenotípicos clave en Escherichia coli y Serratia marcescens que crecen bajo diversas condiciones (niveles de nutrientes y temperaturas), lo que permite un control cuidadoso de la actividad biológica, y cuantifica cómo las conversaciones cruzadas entre los ruidos fenotípicos determinan la oportunidad de la organización estructural y la aparición de transporte local activo. Por lo tanto, este trabajo forja el primer vínculo mecánico directo entre la variabilidad a nivel celular dependiente de la actividad y las propiedades emergentes a escala de población en los sistemas vivos.
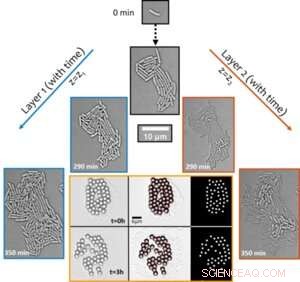
Figura 1. La transición estructural de biopelículas nacientes de una capa a varias impulsa el transporte sincrónico emergente alrededor de la colonia. El fenómeno del transporte activo se descubrió al visualizar el desplazamiento de partículas del tamaño de una micra a lo largo del tiempo (que se muestra en la imagen de seis paneles con borde naranja). Crédito:Universidad de Luxemburgo
Aprovechando un enfoque interdisciplinario y de escala cruzada
Usando una combinación de imágenes de lapso de tiempo de una sola célula, velocimetría de imágenes de partículas, simulaciones numéricas y modelado continuo, el equipo cuantifica la variabilidad a nivel celular en términos de ruido fenotípico y descubre compensaciones que finalmente suprimen la variabilidad en las propiedades emergentes y las convierten en sincrónico. Específicamente, una compensación entre el ruido en la geometría celular y la tasa de crecimiento autorregula el tiempo de la transición de mono a multicapa (MTMT), un paso clave en la iniciación de la biopelícula, desencadenando una cascada hidrodinámica activa sincrónica que en última instancia, impulsa el transporte local mejorado alrededor de las colonias bacterianas confluentes.
Sorprendentemente, a pesar de que la especie no es móvil por naturaleza, la hidrodinámica activa dependiente del crecimiento dentro de las colonias confluentes desencadena flujos locales en su entorno que son lo suficientemente fuertes como para interrumpir los grupos de partículas autoensambladas (utilizadas como trazadores, consulte la Figura 1) y transportarlas. activamente en el entorno microbiano. La mejora en el transporte, en un entorno de difusión limitada, en más de dos órdenes de magnitud sugiere funciones biológicas de dichos flujos activos en el transporte de carga molecular y micro durante las primeras etapas del desarrollo de biopelículas.
Este trabajo presenta un gran avance en el dominio de la física de la materia microbiana activa y proporciona un nuevo paradigma para comprender cómo las poblaciones bacterianas confluentes pueden hacer frente a las variaciones ambientales, incluidas las impuestas por el estilo de vida y los cambios climáticos, aprovechando su variabilidad a escala individual.
Perspectivas sobre el transporte activo sincrónico en biopelículas nacientes
El equipo demuestra que las colonias sésiles pueden generar y aprovechar flujos activos para transportar cargas biológicas de tamaño submicrónico a micrométrico que se encuentran ampliamente asociadas con colonias bacterianas. En conjunto, las dimensiones de tramo de microcarga asociadas van desde decenas de nanómetros hasta unas pocas micras. La microcarga típica incluye células bacterianas (diferentes especies portadoras y de carga de tamaño micrométrico), esporas fúngicas en escala micrométrica; liposomas y vesículas extracelulares que transportan carga genética o bioquímica (tamaño de decenas a cientos de nanómetros), bacteriófagos que hacen autostop (cientos de nanómetros) y perlas y cápsulas sintéticas relevantes para la administración de fármacos (tamaño de submicrones a decenas de micrones).
La importancia biológica del nexo sincronizado en el tiempo entre la estructura, el flujo y el transporte es múltiple:la sincronización estricta de los eventos de extrusión presenta a la MTMT como un representante biofísico de la detección de quórum entre las colonias, con posibles ramificaciones de y en la selección sincrónica de células resistentes (por ejemplo, frente a antibióticos). Interrumpir el tiempo MTMT bien definido (por ejemplo, ajustando adecuadamente los factores ambientales) podría ofrecer alternativas futuras para inhibir la detección de quórum y, por lo tanto, regular la resistencia bacteriana a los antibióticos.
De cara al futuro, será fundamental comprender cómo las colonias sésiles aprovechan el tiempo crítico bien definido para sintonizar las comunicaciones entre colonias en entornos estresantes (en el espacio de parámetros del ruido intrínseco y la sincronicidad temporal del flujo de la estructura). Los fenómenos espacio-temporales mediados por ruido que se presentan en este trabajo brindan información clave que falta sobre la biofísica del desarrollo de la morfogénesis en sistemas con mayor complejidad, incluidos los consorcios polimicrobianos observados en los microbiomas humanos y vegetales, y los sistemas de tejidos multicelulares relevantes para embriones y cáncer. progresión.
Este trabajo abre nuevos caminos de investigación en los campos de la física de la materia activa microbiana, la física blanda y biológica y la biología celular y, debido al importante papel de las biopelículas bacterianas en el microbioma humano y la ecología ambiental, también en las ciencias biomédicas y biotecnológicas. Los resultados topológicos estructurales y multicampo presentados aquí a través de la visión del profesor Sengupta tendrán consecuencias para diversos sistemas confluentes que abarcan sistemas celulares y de tejidos activos, y una amplia gama de modelos de organoides.
Finalmente, este trabajo proporciona un nuevo sistema de modelo experimental para la investigación de la materia activa donde las entidades pasivas coexisten con los agentes activos e inspiran una nueva clase de modelos teóricos que incorporan la variabilidad celular y las compensaciones para comprender el impacto del ruido, un intrínseco. variable biofísica, sobre propiedades emergentes en los sistemas vivos. Los investigadores manipulan la demografía de la comunidad bacteriana con tecnología electrónica novedosa