
Un polímero compuesto por una proteína tubulina, es un componente del citoesqueleto involucrado en el transporte intracelular, movilidad celular y división nuclear. Crédito:AMOLF
Los investigadores de AMOLF han presentado una teoría que describe la fricción entre filamentos biológicos que están reticulados por proteínas. Asombrosamente, su teoría predice que la fuerza de fricción aumenta de manera muy no lineal con el número de reticulantes. Los autores creen que las células utilizan esta escala no solo para estabilizar las estructuras celulares, sino también para controlar su tamaño. Los nuevos hallazgos son importantes para comprender la dinámica de estructuras celulares como el huso mitótico, que separa los cromosomas durante la división celular.
Proteínas motoras versus fuerzas de fricción
Muchas estructuras celulares constan de filamentos largos que están entrecruzados por proteínas motoras y proteínas no motoras (ver figura). Estas denominadas estructuras citoesqueléticas no solo confieren a las células su estabilidad mecánica, pero también les permite arrastrarse sobre superficies y separar los cromosomas durante la división celular. La generación de fuerza se atribuye típicamente a proteínas motoras, cuales, usando combustible químico, pueden mover los filamentos entre sí. Sin embargo, estas fuerzas motoras se oponen a las fuerzas de fricción que son generadas por pasivo, proteínas no motoras. Estas fuerzas de fricción son un determinante central de las propiedades mecánicas de las estructuras citoesqueléticas, y limitan la velocidad y eficiencia con que se forman estas estructuras. Es más, incluso pueden ser vitales para su estabilidad, porque si las fuerzas del motor no se oponen a las fuerzas de fricción generadas por los reticuladores pasivos, las estructuras pueden incluso desmoronarse.
Incremento exponencial
Para comprender la dinámica de estas estructuras citoesqueléticas y las fuerzas que pueden generar, Es esencial comprender cómo las fuerzas de fricción se escalan con la longitud de los filamentos y el número de reticulantes entre ellos. Las teorías existentes predicen que la fricción aumenta linealmente con el número de reticulantes, que es lo que uno esperaría intuitivamente. Sin embargo, experimentos recientes han demostrado vívidamente que las fuerzas de fricción escalan de manera no lineal, es decir, exponencialmente, con el número de reticulantes. Debido a la crisis del COVID-19, todos sabemos la gran diferencia que puede suponer un aumento exponencial frente a un aumento lineal. Hasta ahora, No se entendió el origen de este comportamiento de escala exponencial altamente inusual de la fricción entre filamentos.
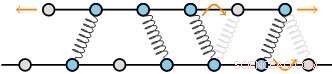
Las estructuras citoesqueléticas están formadas por filamentos reticulados por proteínas. Estos filamentos consisten en una red regular de subunidades, que producen un conjunto discreto de sitios de unión para los reticulantes. La teoría de los autores predice que, como resultado, las fuerzas de fricción escalan muy rápidamente a medida que aumenta el número de reticulantes. Crédito:AMOLF
Explicación
El líder del grupo AMOLF Ten Wolde y Ph.D. El estudiante Wierenga ha desarrollado ahora una teoría que explica estas observaciones experimentales. Su teoría se basa en la observación de que los filamentos biológicos consisten en una red regular de subunidades, produciendo un conjunto discreto de sitios de unión para los reticulantes. Ten Wolde y Wierenga predicen que los filamentos solo pueden moverse si los enlazadores se reorganizan colectivamente. Como resultado de esta reorganización colectiva, las fuerzas de fricción aumentan muy rápidamente, es decir., exponencialmente, con el número de enlazadores.
El trabajo de los autores tiene importantes implicaciones para nuestra comprensión de la dinámica de las estructuras citoesqueléticas. En particular, la escala exponencial significa que estas estructuras se congelan esencialmente cuando la densidad del reticulante excede un cierto umbral; las fuerzas de fricción se vuelven tan altas que impiden cualquier movimiento adicional. Las células pueden utilizar este fuerte escalamiento para controlar el tamaño y la estabilidad de las estructuras celulares.